
题目列表(包括答案和解析)
27.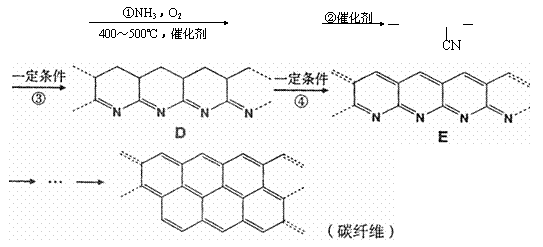 碳纤维质轻、耐高温、有很高的抗拉强度与弹性,它与树脂、金属或陶瓷基体形成的复合材料广泛运用于航天飞机、火箭、导弹的外壳以及体育器具等。碳纤维的合成方法一般经历以下过程:
碳纤维质轻、耐高温、有很高的抗拉强度与弹性,它与树脂、金属或陶瓷基体形成的复合材料广泛运用于航天飞机、火箭、导弹的外壳以及体育器具等。碳纤维的合成方法一般经历以下过程:
CH2=CH-CH3 CH2=CH-CN [ CH2-CH ]n
A B C
请回答下列问题:
(1)反应①的化学方程式: 。
(2)反应②属于 ;反应④属于 。(请选a、b、c、d填空)
a.加聚反应 b.缩聚反应 c.氧化反应 d.还原反应
(3)在化合物A、B、C、D、E中,所有原子可能在同一平面上的是 。
(4)化合物E中碳元素的质量分数接近于 %。(保留1位小数)
26.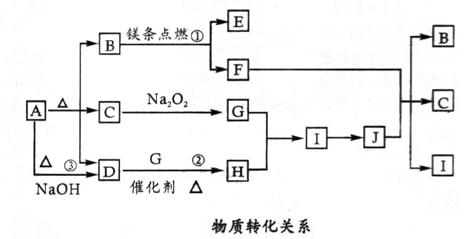 图中A-J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。
图中A-J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。
请填写以下空白:
(1)B的电子式__________,D分子的空间构型__________。
(2)写出反应①②的化学方程式:①__________;②____________。
(3)写出反应③的离子方程式:_______________________________。
25.燃料电池是使气体燃料氧化直接产生电流的装置,这是本世纪最具挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入丁烷,电池的电解质是掺杂了Y2O3(三氧化二钇)的ZrO2(二氧化锆)晶体,它在高温下能传导O2-。试回答下列问题:
(1)该电池放电时的化学反应方程式为 。
(2)该燃料电池的电极反应式为:
电池正极 13O2+52e- 26O2-
电池负极 2C4H10+26O2--52e- 8CO2+10H2O
则固体电解质中的O2-向 极移动(填“正”或“负”)
(3)某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出3360mL(标准状况)氧气,阴极析出金属10.4g,在该含氧酸盐中金属的化合价为 ,在该实验中,若不考虑能量的损失,电池中消耗丁烷的质量最少是 g(结果精确至0.01g)
24.化学工业在江苏国民经济中占有极其重要的地位,我省是国内最早的硫酸生产基地之一。
(1)硫酸生产中,根据化学平衡原理来确定的条件或措施有_______(填序号)
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.接触室中不使用很高的温度
D.净化后炉气中要有过量的空气
E.接触氧化在常压下进行
F.吸收塔中用98.3%的浓硫酸吸收SO3
(2)若实验室外在537oC、1.01×105Pa和催化剂存在条件下,向某密闭容器中充入1 mol SO2和0.5 mol O2,此时体积为100L,在温度和压强不变条件下反应达到平衡,SO3体积分数为0.91。若保持温度和压强不变,充入1 mol SO3,则平衡时SO2体积分数为____________;若保持温度和体积不变,充入a mol SO2和b mol O2,且a:b=2:1,反应达平衡时SO3体积分数仍为0.91,则a=__________。
(3)硫酸工业的尾气中含有少量的SO2,常用氨水吸收后再加硫酸,回收SO2同时得到化肥硫酸铵,硫酸铵溶液中各离子物质的量浓度由大到小的顺序为_______。
23.A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。
①元素Y在A、B、C、D、E中所呈现的化合价依次递增,其中只有B为单质;
②常温下将气体D通入水中发生反应,生成C和E;
③工业上以A、空气和水为原料,通过催化氧化法制取E。
请回答以下问题:
(1)B的电子式为___________,A的结构式为____________;
(2)写出②中涉及反应的化学方程式________________;
(3)由B反应生成1 mol A放出的热量为46.2 kJ,写出该反应的热化学方程式,并注明反应条件____________________________________________________;
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应的化学方程式__________________________。
22.恒温、恒压下,在一个容积可变的密闭容器中发生如下反应:
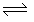 A(g)+B(g) C(g),若开始时通入1molA和1molB,到达平衡后,生成amolC。则下列说法错误的是
A(g)+B(g) C(g),若开始时通入1molA和1molB,到达平衡后,生成amolC。则下列说法错误的是
①若开始时通入3molA和3molB,到达平衡后,生成C的物质的量为3amol
②若开始时通入xmolA、2molB和1molC,到达平衡后,A和C的物质的量分别为ymol和3amol,则x=2,y=1.5
③若开始时通入4molA、4molB和2molC,到达平衡后,B的物质的量一定大于4mol
④若开始时通入2molA、2molB和1molC,到达平衡后,再通入3molC,则再次达平衡后,C的物质的量分数为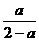
A.②④ B.③④ C.③ D.②③
21.K35ClO3晶体与H37Cl浓溶液反应,生成氯气、氯化钾和水,此反应生成的这种氯气的摩尔质量为
A.74g·mol-1 B.73.3 g·mol-1 C.72 g·mol-1 D.70.6 g·mol-1
20.在一定温度下,b g固体A能完全溶解于水形成(a+b)g溶液(固体A不含结晶水,也不与水反应),则该温度下,固体A的溶解度肯定不可能的是
A.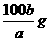 B.
B.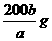 C.
C.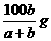 D.
D.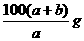
19.过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒(如:SARS病毒)、细菌、真菌及芽孢,有关过氧乙酸的叙述正确的是
A.过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
B.过氧乙酸可与苯酚混合使用
C.由过氧化氢与醋酸制取过氧乙酸的反应属于氧化还原反应
D.浓过氧乙酸中加入少许紫色石蕊试液,振荡后试液一定呈红色
18.
都属于萘的同系物。萘和萘的同系物分子组成通式是
A.CnH2n-6(n≥11) B.CnH2n-8(n>10) C.CnH2n-10(n≥10) D.CnH2n-12(n≥10)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com