
题目列表(包括答案和解析)
19.(7分)(1)实验室现有蒸馏水、稀氨水、KNO3溶液、稀H2SO4和浓HNO3。请说明你如何从上述药品中选用试剂,通过必要的操作,将内壁附有银镜的试管洗涤干净。
(2)下列操作会导致实验值较实际值(或要求值)偏低(或偏小)的是__________ (填代号)。
A.测定硫酸铜晶体中结晶水含量时,将加热后的坩埚(内盛药品)置于干燥器中冷却后再称量
B.中和热测定实验中以环形铁丝搅拌棒代替环形玻璃搅拌棒
C.酸碱中和滴定实验中,将待测NaOH溶液装于碱式滴定管,标准HCl溶液盛于锥形瓶(以酚酞作指示剂),进行滴定
D.配制100 mL2 mol/L的NaCl溶液,以胶头滴管加水定容时,液面稍超出容量瓶刻度线,反复摇匀后,凹液面最低点恰好与刻度线平齐
18.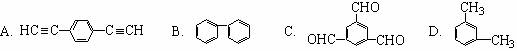 有甲、乙两醋酸稀溶液,测得甲的pH=a,乙的pH=a+1。下列推断中正确的是
有甲、乙两醋酸稀溶液,测得甲的pH=a,乙的pH=a+1。下列推断中正确的是
A.物质的量浓度c(甲)=10c(乙)
B.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍
C.中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)>10V(甲)
D.甲中的c(OH-)为乙中c(OH-)的10倍
◇请将第Ⅰ卷的答案填入下表:
第II卷(非选择题共78分)
17.工业上将苯蒸气通过赤热的铁合成一种传热载体化合物,其分子中苯环上的一氯取代物有3种,1 mol该化合物催化加氢时最多消耗6 mol H2,则该传热载体化合物的结构简式是
16.恒温恒容下,往一真空密闭容器中通入一定量的气体A,发生如下反应:2A(g)
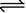 B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
B(g)+xC(g)。达平衡后,测得容器内的压强增大了p%,A的平衡转化率为a%,则下列推断中正确的是
A.若x=1,则p>a B.若x=2,则p<a
C.若x=3,则p=a D.若x=4,则p≥a
15.设NA表示阿伏加德罗常数,下列叙述中正确的是
A.常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5 NA
B.1 mol Na2O2与足量的水反应,转移的电子数为2NA
C.标准状况下,22.4 L NO2气体中的分子数约为NA
D.常温常压下,3l g白磷分子中的共价键数为6NA
14.能正确表示下列反应的离子方程式或电极反应式的是
A.碳酸钠和碳酸氢钠的混合溶液中滴加少量稀硫酸:HCO3-+H+=CO2↑+H2O
B.漂白粉溶液中通入少量二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
C.苯酚钠溶液中通入过量的二氧化碳:2C6H5O-+CO2+H2O → 2C6H5OH+CO32-
D.工业上电解饱和食盐水,阳极电极反应式:2Cl――2e-=Cl2↑
13.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
12.下列无色澄清的溶液中,可能大量共存的离子组是
A.[Ag(NH3)2]+、K+、OH-、NO3- B.Fe3+、NH4+、Cl-、I-
C.H+、Al3+、SO42-、F- D.NH4+、Na+、AlO2-、Cl-
11.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正
确的是
A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
10.共价键的断裂有均裂和异裂两种方式,即:A∶B → A·+B· ,均裂:A∶B → A++[∶B]-,异裂。下列化学反应中发生共价键均裂的是
A.2K+2H2O=2KOH+H2↑
B.2Na+2C2H5OH → 2C2H5ONa+H2↑
C.Na2CO3+H2O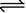 NaHCO3+NaOH
NaHCO3+NaOH
D.CH3COOH+C2H5OH  H2O+CH3COOC2H5
H2O+CH3COOC2H5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com