
题目列表(包括答案和解析)
23.(3分)标准状况下,1体积水可以溶解700体积氨气,所得溶液的密度为0.90g·mL-1,则该氨水的物质的量浓度为 。
22.(9分)已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH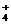 、Ba2+、Na+、H+、SO
、Ba2+、Na+、H+、SO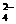 、NO
、NO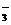 、OH-、CO
、OH-、CO 。将这四种溶液分别标记为A、B、C、D,进行如下实验:
。将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成
②D和B反应生成的气体能被A吸收
③A和D反应生成的气体能被B吸收
试回答下列问题:
(1)D的化学式是 ,判断理由是
。
(2)写出其余几种物质的化学式:A B C
(3)写出实验②中有关反应的离子方程式
。
21.(7分)(1)配平下列氧化还原方程式:
FeSO4+ KNO3+ ( )= K2SO4+ Fe2(SO4)3+ NO+ H2O
(2)A、B、C、D是原子序数小于20的四种元素,A与B同主族且能形成AB2型分子,A、C、D所形成的简单离子具有相同的核外电子排布,且离子半径依次减小。请回答:
①证明某化合物中含有D元素采用的实验方法为 ,现象是 。
②写出C的单质通入AB2的水溶液中所发生反应的离子方程式:
。
20.(4分)(1)在品红溶液中加入新制的氢氧化铝,溶液红色褪去,其褪色原理与下列中的
(填代号)物质相同。
A.活性炭 B.SO2 C.氯水
(2)少量Na2O2投入水中,待反应后再滴入品红溶液,红色褪去,说明溶液中存在
(填化学式),其褪色原理与上述(1)中的原理 (填相同
或不相同)。
0.1℃,下同),记入表格;
②用另一个量筒量取50mL 0.55mol·L-1的NaOH溶
液,并用温度计测量氢氧化钠溶液的温度,记入表
格;
③在两个烧杯之间填满碎泡沫,并使杯口相平;盖板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过;
④把量筒中的氢氧化钠溶液倒入小烧杯中,并立即把套有盖板的温度计和环形玻璃搅拌棒放入小烧杯中,用玻璃搅拌棒轻轻搅动溶液,准确读取混合溶液的温度,记入表格。
再重复实验两次,所得数据如下:
|
实验编号 |
起始温度t1/℃ |
终止温度 (t2/℃) |
温度差 (t2-t1)/℃ |
||
|
盐酸 |
氢氧化钠溶液 |
平均值 |
|||
|
1 |
20.0 |
20.0 |
20.0 |
23.4 |
3.4 |
|
2 |
20.0 |
20.0 |
20.0 |
23.4 |
3.4 |
|
3 |
20.0 |
20.0 |
20.0 |
21.6 |
1.6 |
回答下列问题:
(1)实验步骤的先后顺序为(填编号) 。
(2)步骤①、②中都使用了温度计,若使用同一支温度计,应注意的问题是
。
(3)试根据上述数据计算中和热[盐酸和氢氧化钠溶液的密度近似为1g/cm3,反应后溶液的比热容近似为4.18J/(g·℃)],并据此写出该反应的热化学方程式
。
(4)下列操作能够减少实验误差的是 (填代号)。
A.用保温杯代替烧杯
B.步骤②中的氢氧化钠溶液分多次倒入小烧杯中
C.步骤④中读取混合溶液的最高温度作为终止温度
D.其它数据不变,把50mL的盐酸和氢氧化钠溶液都改为5mL
E.其它数据不变,把盐酸和氢氧化钠溶液的浓度都增加10倍
(5)若将盐酸和氢氧化钠溶液分别改为醋酸和氨水,其它数据不变,则测得的中和热与上述实验测得的中和热比较 (填偏大、偏小或相同),原因是
。
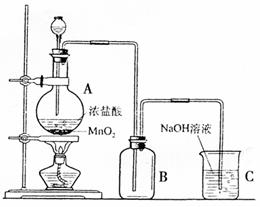
18.(8分)右图是某同学在实验室中制取
Cl2的装置图:
(1)该装置中的错误之处有二,分别是:
①
②
(2)试写出装置A和C中发生反应的离
子方程式:
A处: ;
C处: 。
(3)甲、乙两同学分别采用下列两种方案制取Cl2。
甲:用含HCl 146 g的浓盐酸与足量的MnO2反应;乙:用87 g MnO2与足量浓盐酸反应,则所得氯气 (填代号)。
A.甲比乙多 B.乙比甲多 C.一样多 D.无法比较
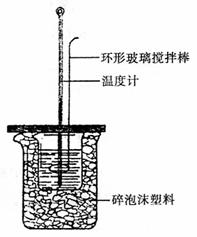 19.(11分)实验室用右图所示装置测定中和热。实验
19.(11分)实验室用右图所示装置测定中和热。实验
步骤如下:
①用一个量筒量取50mL 0.5mol·L-1的盐酸,倒入
小烧杯中,并用温度计测量盐酸的温度(均读准至
17.使5.6L CO2气体迅速通过Na2O2固体后得到4.48L气体(标准状况),这4.48L气体的质量为 ( )
A.8.8g B.6.4g C.8.2g D.6.2g
第Ⅱ卷(非选择题,共54分)
 三、(本题包括2小题,共19分)
三、(本题包括2小题,共19分)
16.在100g浓度为18mol·L-1、密度为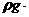 cm-3的浓硫酸中加入一定量的水,稀释成
cm-3的浓硫酸中加入一定量的水,稀释成
9mol·L-1的硫酸,则加入水的体积为 ( )
A.小于100mL B.等于100mL
C.大于100mL D.等于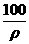 mL
mL
15.物质的量均为1 mol的下述物质,长期放置于空气中(不考虑潮解情况),最后质量增加的大小关系是 ( )
①氧化钠 ②过氧化钠 ③氢氧化钠 ④亚硫酸钠
A.①=③>②>④ B.①>②>④>③
C.③>①=②>④ D.④>③>②>①
14.制备氰氨基化钙的化学方程式如下:CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑,关于该反应的下列说法,正确的是 ( )
A.氢元素被氧化,碳元素被还原
B.HCN既是氧化剂又是还原剂
C.CaCN2是还原产物,H2是氧化产物
D.CO为氧化产物,H2为还原产物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com