
题目列表(包括答案和解析)
5. 某学生用碱式滴定管量取 0.1mol·L-1的NaOH溶液,开始时仰视液面,读数为11.0mL,
取出部分溶液后,俯视液面,读数为19.0mL,实际取出液体的体积
A.大于8 mL B.小于8 mL C.等于8 mL D.无法确定
4.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有
A.滴加石蕊试液显红色的溶液
Fe3+ 、NH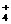 、Cl- 、SCN-
、Cl- 、SCN-
B.pH值为-1的溶液
Na+ 、Mg2+ 、I-、NO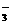
C.水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO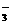 、Br-、Ba2+
、Br-、Ba2+
D.所含溶质为Na2SO4的溶液
K+ 、CO32-、NO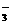 、Al3+
、Al3+
3. 实验室制备硝酸铝[Al(NO3)3·9H2O]可使用下列方法:
 。
。
反映上述有关反应的离子方程式错误的是
A.2Al+2OH-+2H2O=2AlO2-+3H2↑
B.2HCO3-+2AlO2-+H2O=2CO2↑+2Al(OH)3↓
C.NH4++AlO2-+2H2O=NH3·H2O+ Al(OH)3↓
D.3H++Al(OH)3=Al3++3H2O
2. 设NA为阿伏加德罗常数。下列叙述中不正确的是
A.标准状况下,22.4 L CO2和CO混合气体中含有的碳原子数约为NA
B.常温常压下,0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.2 NA
C.0.25mol O2的摩尔质量为 8 g · mol-1
D.1 L 1 mol·L-1的NaHCO3溶液中离子总数大于2NA
1. 下列变化能够实现的是
①溶液中两种盐之间反应未得到两种新盐
②在溶液中,弱酸与盐反应生成强酸
③一种单质在另一种气体中燃烧,发生的反应不是化合反应
④两种非金属氧化物之间发生反应生成另一种氧化物和一种其他物质
A.①②③ B.②③④ C.①③④ D.①②③④
12、发生炉煤气是城市管道煤气中的一种重要气源,它的生要成分是CO,但由于CO有毒,所以煤气厂技术人员利用以下反应,将部分CO转换成H2:CO+H2O(g) CO2+H2
CO2+H2
(1)在一定条件下,上述反应达到平衡,则混合物中碳的氧化物中碳、氧元素的质量比可能是 (C)
A 3:1 B 3:4 C 3:5 D 3:8
(2)设CO的转化率为75%,则碳的氧化物中m(C):m(O)为 (3:7)
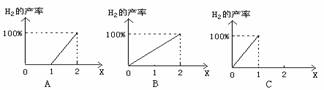
(3)现用COx表示平衡混合物中的碳的氧化物的组成,则表示x与反应CO+H2O(g) CO2+H2中H2产率关系正确的是
(A)
CO2+H2中H2产率关系正确的是
(A)
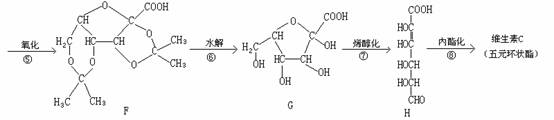
11、维生素C又名抗坏血酸,可预防感染、坏血症等,也是一种常见的食品添加剂,能阻止空气中的氧气将食品氧化变质。维生素C的工业合成路线如下:
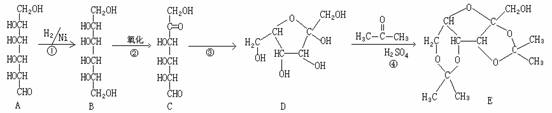
(1)上述合成过程中与A互为同分异构体的有 (填写字母代号,下同)。
(2)上述反应中,属于加成反应的有 (填数字序号)
(3)反应④除了生成E外,还有 生成。比较D和G的结构可知,G可看作是由D通过反应⑤氧化得到,那么在工业上设计④和⑥两步的目的是
(4)维生素C的结构简式是
(5)苹果汁是人们喜爱的饮料,由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加维生素C则可有效防止这种现象的发生。这说明维生素C具有
A 氧化性 B 还原性 C 碱性 D 酸性
(6)从维生素C的结构来看,它的官能团有 种
A 2 B 3 C 4
(1)C D(2)①③ (3)H2O 保护D分子羟基不被氧化 (4)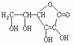 (5)B(6)B
(5)B(6)B
10、SO2和CO2一样是一种酸性氧化物,也具有下列性质:
SO2(少量)+Ca(OH)2==CaSO3↓(白色)
CaSO3+SO2+H2O==Ca(HSO3)2(溶于水)。
某同学为了验证SO2也具有上述性质,将SO2通入到澄清的石灰水中,却发现没有看到有沉淀生成再溶解的过程。经过一番思考,该同学想到了两个原因。
(1)如果你做这个实验,你认为看不到上述现象的原因是:
、 。
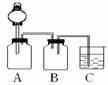 该同学认为问题的的关键在于SO2的通入速率太快,他重新设计了实验,使实验圆满成功。实验装置如下:
该同学认为问题的的关键在于SO2的通入速率太快,他重新设计了实验,使实验圆满成功。实验装置如下:
其中A是贮气瓶,里边盛放有SO2气体,通过分液漏斗控制液滴的下滴速度,来达到控制SO2的流速的目的。
(2)分液漏斗中盛放的液体最好是:
A 饱和的NaCl溶液 B H2O C 稀盐酸 D 饱和的NaHSO3
(3)B装置的名称是 ,所起的作用是 。
(4)C装置中为了能够明显观察到石灰水由混浊到澄清的现象,该同学还加入了适量的NaOH,它的作用是 。
(5)该同学实验设计的欠缺之处在于 。
(1)SO2的溶解性大,在溶液中的浓度大,有更多的H2SO3生成。
H2SO3的酸性更强,极易使Ca(OH)2转化成Ca(HCO3)2。
(2)D
(3)安全瓶 防止液体倒吸
(4)和SO2反应生成SO32-,有利于看到白色沉淀。
(5)缺少一个尾气吸收的装置。SO2对空气有污染。
9、0.1 mol某种烯烃或两种烯烃的混合物(碳原子数均不超过5)充分燃烧后,生成的二氧化碳完全被300 mL 2 mol·L-1的氢氧化钠溶液吸收。所得溶液中含有两种物质的量相等的溶质。
(1)若为纯净物,试推断符合条件烯烃可能有的分子式:
① ;② ;③ 。(可以不填满,也可以补充)
(2)若为两种烯烃的混合物,试推断符合条件可能的组成及体积比(可以不填满,也可以补充)
|
序 号 |
组 成 |
体积比 |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
(1)C4H8;(2)①C2H4和C5H10体积比1:2 ②C3H6和C5H10体积比1:1
8、铜和镁的合金4.6克完全溶解于浓硫酸中,若反应中硝酸被还原只产生4480mL的NO2气体和336mLN2O4气体(已折算到标准状态),在反应后的溶液中,加入足量的氢氧化钠溶液,生成的沉淀的质量为 (B)
A 9.02g B 8.51g C 8.26g D 7.04g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com