
题目列表(包括答案和解析)
8、某溶液中含有HCO3- 、SO32- 、CO32- 、NH4+ 离子,向其中加入Na 2 O 2 固体,溶液中离子浓度增加的是 ( )
A.HCO3- B. NH4+ C. CO32- D.SO32-
7、硫代硫酸钠可作为脱氯剂,已知25.0ml 0.100mol/LNa2S2O3溶液恰好把224ml(标态)Cl2完全转化为Cl-,则S2O32-将转化为( )
A、S2- B、S C、SO32- D、SO42-
6、下列有关实验中,用所选用的试剂(括号内物质)不能达到目的的是( )
A.检验Na2SO4溶液中是否混有NaCl(AgNO3溶液)
B.证明FeCl2溶液被氧化(KSCN溶液)
C.除去C2H2气体中的H2S气体(CuSO4溶液)
D.鉴别SO2和CO2两种气体(溴水)
12.(21分) 要求写出必要的文字说明、化学方程式和重要的解题步聚,只写出最后答案不给分。
著名的“侯氏制碱法”的第一步反应是向饱和食盐水中通入CO2而析出NaHCO3,该反应可表示为:NH3 + NaCl + CO2 + H2O = NaHCO3↓+ NH4Cl, 已知NaCl、NaHCO3、NH4Cl在不同温度的溶解度如下:
|
物质 |
NaCl |
NaHCO3 |
NH4Cl |
|
40℃时溶解度/g |
37 |
13 |
46 |
|
10℃时溶解度/g |
|
|
33 |
今在40℃时,向434 g饱和食盐水中通入44.8 L(标准状况)NH3,再向溶液中通入过量的CO2,
(1)可析出NaHCO3多少克?
(2)NH4Cl能否析出?
(3)若降温至10℃,可析出NH4Cl多少克?
(4)降温至10℃时,若要析出更多的NH4Cl晶体应采取什么措施?
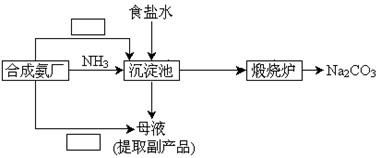
(5)某学生利用合成氨厂的原料和产物,设计了一个能充分利用各组成物质同时达到制取纯碱和回收氯化铵的实验方案。请你补充完整该学生的流程框图。
11.(16分) 某含有少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的含量。实验采用以下步骤进行:
①准确称量m g样品(2~3g);
②向样品中加入10mL 5mol/L的盐酸,再加入蒸馏水,配制成250mL溶液;
③量取25mL操作②中配得的溶液,加入3mL溴水,加热使之完全反应;
④趁热迅速加入浓度为10%的氨水至过量,充分搅拌,使之完全沉淀;
⑤过滤,将沉淀洗涤、灼烧、冷却称量,反复操作至恒重。
请根据上面的叙述回答:
(1)若称量前,托盘天平的指针偏向标尺左方;称量读数时,指针刚好在标尺的中间,则所得样品的质量 。
A、比mg多 B、比mg少 C、恰好为mg D、不能确定
(2)溶解样品时要加入盐酸,原因是 。
(3)配制250mL溶液时,除需玻璃棒、烧杯外,还需用到的玻璃仪器是: 。
(4)加入溴水时发生反应的离子方程式是 。
(5)若坩埚质量为W1 g,坩埚与灼烧后固体的总质量是W2 g,则样品中铁元素的质量分数是 。
(6)若在配制250mL溶液时,所用的容量瓶没有洗干净。当含有下列物质时,最终会使铁元素的测定含量(填“偏高”、“偏低”或“不变”)。
①NaCl ;②Fe2(SO4)3 。
10.(9分) 多硫化物S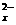 (X的数值在2~6之间)在碱性溶液中被BrO
(X的数值在2~6之间)在碱性溶液中被BrO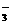 氧化为SO
氧化为SO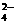 ,而BrO
,而BrO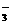 被还原为Br-,在反应中消耗BrO
被还原为Br-,在反应中消耗BrO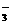 和OH-的物质的量之比为2 : 3,则
和OH-的物质的量之比为2 : 3,则
(1)X的值为 。
(2)反应的离子方程式 。
(3)此反应的还原剂与氧化剂物质的量之比是 。
9.(14分)已知D是单质,其他均是常见的化合物,它们之间的转化关系如下图所示,其中
M(A)<M(B)。
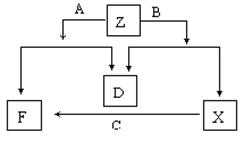
回答下列问题:
(1)符合此转化关系的A、B、D的化学式分别是:
A 、B 、D ;
(2)写出Z的电子式: , Z中阴阳离子数之比为:
(3)写出X转化为F的离子方程式:
(4)室温下,将2g苯和过量的D混合,完全燃烧,放出83.6kJ的热量,写出苯燃烧热的热化学方程式 。
8.某结晶水合物化学式为R·nH2O,其式量为M。 25℃时,将a g该晶体溶于b g H2O中恰好形成V ml饱和溶液。下列表示式正确的是
A.饱和溶液物质的量浓度为: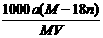 mol·L-1
mol·L-1
B.饱和溶液溶质的质量分数为: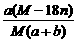 %
%
C.25℃时R的溶解度为: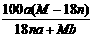 g
g
D.饱和溶液的密度为: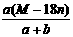 g·mL-1
g·mL-1
7.将一定量的钠、铝合金置于水中,合金全部溶解,得到20ml、pH=14的溶液.然后用1mol/L的盐酸滴定至沉淀量最大时,消耗盐酸40ml。原合金中钠的质量为
A.0.92g B.0.69g C.0.64g D.0.23g
6.已知某溶液中含有碳酸钠、硫酸钠、氢氧化钠、氯化钠四种溶质,欲将该溶液中四种溶质的阴离子逐一检验出来,所加试剂先后顺序合理的是
A.HNO3、Ba(NO3)2、NH4NO3、AgNO3
B.HNO3、NH4NO3、Ba(NO3)2、AgNO3
C.NH4NO3、HNO3、Ba(NO3)2、AgNO3
D.NH4NO3、HNO3、AgNO3、Ba(NO3)2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com