
题目列表(包括答案和解析)
例1 G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平) ①G→Q+NaCl,②Q+H2O→X+H2,③Y+NaOH→G+Q+H2O,④Z+NaOH→Q+X+H2O。这五种化合物中氯的化合价由低到高的顺序为( )
(A)Q、G、Z、Y、X (B)G、Y、Q、Z、X
(C)G、Y、Z、Q、X (D)Z、X、G、Y、Q
例2 将0.04molKMnO4固体加热一段时间后,收集到a mol气体,此时KMnO4的分解率为X。在反应后的残留固体中加入足量的浓盐酸,又收集到b mol气体(设Mn元素全部以Mn2+存在于溶液中)。试填写:
(1)a+b= (用X表示);
(2)当X= ,a+b取最小值且为 ;
(3)当a+b=0.09mol时,加热后所得残留固体的质量为 克。
例3 在P4+CuSO4→Cu3P+H3PO4+H2SO4的反应中,被1mol CuSO4氧化的白磷的物质的量是( )
A、1mol B、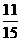 mol
C、
mol
C、 mol D、
mol D、 mol
mol
例4 用氯气对饮用水消毒会使饮用水中的有机物发生氯代,生成有机含氯化合物,对人体有潜在的危害作用。世界环保联盟即将全面禁止用氯气对饮用水消毒,建议采用广谱高效的二氧化氯(ClO2)。
(1)二氧化氯具有很强的氧化性,常被用作消毒剂,其消毒的效率(以单位质量得到的电子的物质的量表示),是Cl2的 倍。
(2)使用ClO2作饮用水消毒剂的优点是 。
(3)目前,欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,且Cl2体积为ClO2的一半。表示这一反应的化学方程式是 。
(4)我国最近研究成功用Cl2氧化亚氯酸钠((氮气保护下)制得ClO2,表示这一反应的化学方程式是这一方法的优点是 。
(5)在H2SO4酸性条件下,用Na2SO3还原NaClO3也可制得ClO2,表示这一反应的化学方程式是 。
例5(05上海)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2 已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 。
4、氧化还原反应方程式的配平 见《如东课堂突破》
3、氧化还原反应的重要规律
(1) 定量规律:在同一氧化还原反应中,氧化剂所得到的电子总数与还原剂失去电子的总数相等(化合价升高总数与化合价降低总数相等)。
(2) 反应先后规律:若溶液中同时含有几种还原剂,若加入氧化剂,则优先与氧化剂反应的是还原性最强的物质。
(3) 同种元素间的氧化还原规律:同种元素同种价态发生氧化还原反应时,其价态为中间变两头(一高一低);同种元素不同价态发生氧化还原反应,则为两头价态靠中间(只靠拢,不交叉)。
2、判断物质氧化性、还原性的方法
总原则:物质的氧化性和还原性的强弱决定于元素得失电子的难易程度,与得失电子数的多少无关;物质越易得电子则其氧化性越强,物质越易失电子则其还原性越强。
(1) 根据金属活动性顺序判断:按金属活动顺序表从左到右,金属单质还原性逐渐减弱,对应金属阳离子氧化性逐渐增强。
(2) 根据反应条件难易判断:不同氧化剂与同一还原剂反应,反应条件越易,氧化性越强;不同还原剂与同一氧化剂反应,反应条件越易,还原性越强。
(3) 同一反应中,氧化剂和氧化产物都有氧化性,氧化性强弱:氧化剂>氧化产物;还原剂和还原产物都有还原性,还原性强弱:还原剂>还原产物。
(4) 根据与同种物质反应的情况判断:不同的氧化剂与同种还原剂反应,还原剂中元素被氧化的价态越高,该氧化剂的氧化性就越强。
1、基础内容 见《如东课堂突破》
6、 依据质量守恒、电子、电荷守恒等解决一些计算型问题。
今后命题会继续在上述几方面进行,同时有可能推出新的题型、新的设问方式,特别是与工农业生产、日常生活、科学实验等实际相结合的知识。
5、 氧化还原反应的方程式的配平;
4、 比较氧化剂的氧化性或还原剂的还原性的强弱;
3、 判断反应是否属于氧化还原反应;
2、 计算电子转移的数目;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com