
题目列表(包括答案和解析)
5、碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
A、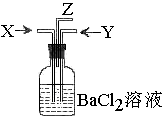 气瓶中产生的沉淀是碳酸钡
气瓶中产生的沉淀是碳酸钡
B、 Z导管出来的气体中无二氧化碳
C、 气瓶中产生的沉淀是硫酸钡
D、Z导管口有红棕色气体出现
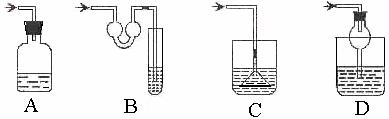
4、以下各种尾气吸收装置中,适合于吸收易溶性气体,而且能防止倒吸的是( )
3. (全国理综卷Ⅱ)
(全国理综卷Ⅱ)
下图中的实验装置可用于制取乙炔。
请填空:
(1) 图中,A管的作用是
,制取乙炔的化学方程式是 。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是 ,
乙炔发生了 反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是 ,
乙炔发生了 反应。
(1) 为了安全,点燃乙炔前应
乙炔燃烧时的实验现象是 。
(上海)
2.(理综北京)
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
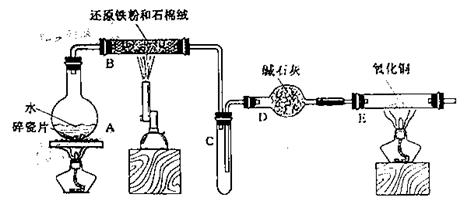
(1)装置B中发生反应的化学方程式是 。
(2)装置E中的现象是 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法: 。
(1) 该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:

滤液 FeCl3溶液 FeCl3·6H2O晶体
①步骤Ⅰ中通入Cl2的作用是
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
。
1.(浙江)
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。

主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将ag试样放人锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到bg
④从分液漏斗滴人6mo1·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到cg
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为dg
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明____________________
(2)装置中干燥管B的作用是__________________
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_____________(填偏高、偏低或不变)
(4)步骤⑤的目的是______________ (5)步骤⑦的目的是____________________
(6)该试样中纯碱的质量分数的计算式为_____________________________
(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
15.自然界存在的碳酸类铜矿(如孔雀石、石青等)的化学组成为:aCuCO3·bCu(OH)2(a、b正整数,且a≤2,b≤2)。(1)将孔雀石、石青矿样分别加盐酸至完全溶解,耗用HCl物质的量与产生CO2物质的量之比:孔雀石为4:1;石青为3:1。
则它们的化学式为:孔雀石:________________石青:
(2)今有一份碳酸盐类铜矿样品,将其等分为A、B两份。然后,加盐酸使A样品完全溶解,产生CO2 3.36L(标准状况);加热B样品使其完分解,得到20g CuO。试计算并确定该矿石的化学组成。
(3)某碳酸盐类铜矿样加酸完全溶解后,产生CO2 6.72L(标准状况),这份矿样中CuO含量不低于_________克。
(4)设某碳酸盐类铜矿样的质量为A克,所含CuO质量为G克。加酸完全溶解后,产生的CO2体积(标准状况)为V升,则含铜矿的A、V、G之间的关系式为:A=______________________________。
14.要除去下表中各粉末状混合物中的杂质(括号内为杂质),填写所用试剂和操作:
|
样品 |
所加试剂 |
主要操作 |
化学方程式 |
|
SiO2(CaCO3) |
|
|
|
|
CaCO3(SiO2) |
|
|
|
|
Fe(Si) |
|
|
|
|
SiO2(H2SiO3) |
|
|
|
13、Ⅰ.实验室用下图的装置将CO2和CO进行分离和干燥.已知a、b均为活塞,试回答
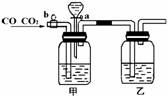
(1)甲瓶中装的是 溶液,乙瓶中装的是 溶液,分液漏斗中装的是 .
(2)当CO2与CO的混和气体通过该装置时,先分离得到的是 ,活塞操作是 ;然后得到 ,活塞操作是 .
Ⅱ.在没有现成CO2气体发生器的情况下,请你选用如图中部分仪器装配成一个简易的、能随开随用的、随关随停的CO2气体发生装置.
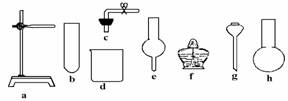
(1)应选用的仪器是(填入编号) .
(2)若用上面已装配好的实验装置制取CO2气体,而实验室只有稀H2SO4、浓HNO3、 水、块状纯碱、块状大理石.比较合理的方案,你认为应选的药品是________________________________________________________________.
12、某核素R具有微弱放射性,其原子核内中子数比质子数多43。由R组成的固体单质A,在一定条件下密度为6.88g/cm3。用x射线研究固体A表明,在边长为1.00×10-7cm的立方体中含有20个原子。R在化学反应中常表现为+2、+4价。在溶液中R2+稳定,而R4+有强氧化性。请回答:
(1) R原子的摩尔质量为_________________________;
(2) R元素位于周期表的第_______周期_________族,名称为________;
(3) 将SO2通入到黑色的RO2悬浊液中有白色沉淀生成,此反应的方程式为
_______________________________________________________;
(4) 在Mn2+的溶液中加入HNO3无明显变化,再加入RO2,溶液变紫红色;如果将HNO3改为盐酸,则不显紫红色。写出有关反应的离子方程式:
___________________________________________________________,
___________________________________________________________。
11、BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称.若知:①在BGO中,锗处于其最高价态,②在BGO中,铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子稳定结构,③BGO可看成 是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同.请填空:
(1)锗和铋的元素符号分别是 和 .
(2)BGO晶体中所含铋氧化物的化学式是 .
(3)BGO晶体的化学式是 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com