
题目列表(包括答案和解析)
1.某能使石蕊试液变红的溶液中,能大量存在的离子是()
A.Al3+ NH4+ SO42- CI- B.Na+ Mg2+ HCO3- NO3-
C.K+ Na+ AlO2- Cl- D.Fe2+ K+ NO3- Cl-
4、定性中有定量,如“由水电离出的H+或OH-浓度为1×10-amol/L的溶液中,(a可以大于7或小于7)……”等。
典型例题
例1、在pH=0的无色透明溶液中,因发生氧化还原反应而不能大量共存的离子组是
A.Na+、K+、MnO4-、Cl- B.Cl-、S2O32-、K+、Na+
C.Na+、Cl-、CH3COO-、K+ D.K+、I-、Na+、ClO-
例2、(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,写出发生反应的离子方程式:_____ ______。在以上中性溶液中继续滴加Ba(OH)2溶液,写出此步反应的离子方程式:_____ ______。
(2)向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至恰好不再生成沉淀时为止,写出反应的离子方程式:____________________________________。在以上溶液中,继续加NaHSO4溶液,写出此步反应的离子方程式:______ _____。
(3)向Ba(OH)2溶液中,逐滴加入明矾溶液至溶液中Ba2+恰好完全沉淀,其反应的离子方程式是:______ _____。在上述溶液中,继续滴加明矾溶液,写出此步反应的离子方程式:________ ___。
课堂练习
3、离子共存,增加限制条件:如强酸(碱)性、无色透明、pH=1、甲基橙呈红色、发生氧化还原反应等。
2、能应用离子的化学性质,书写新情境下的离子方程式。
1、理解离子反应的概念。能正确书写离子方程式。近几年的高考中有关离子方程式的书写及正误判断是每年必考的内容。
10、(黑、吉、桂)某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的硅酸盐质实验仪器有_______________(填代号,限填3项)。
A、试管 B、瓷坩埚 C、坩埚钳 D、铁三角架
E、泥三角 F、洒精灯 G、烧杯 H、墨筒
(2)第2步:Iˉ溶液的获取。操作是_________________________________________。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用_________(填代号)。
A、浓硫酸 B、新制氯水 C、KMnO4溶液 D、H2O2
理由是__________________________________________________________________。
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
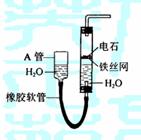 11.(16分)下图中的实验装置可用于制取乙炔。
11.(16分)下图中的实验装置可用于制取乙炔。
请填空:
(1)图中,A管的作用是
。
制取乙炔的化学方程式是
。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是 ,
乙炔发生了 反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是 ,
乙炔发生了 反应。
(4)为了安全,点燃乙炔前应 ,
乙炔燃烧时的实验现象是
。
9、(广东卷)
研究性学习小组进行SO2的制备及性质探究实验。
(1)根据反应Na2SO3(固)+H2SO4(浓)= Na2SO4 + SO2↑+ H2O,制备SO2气体。
①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。

②实验过程中,使用分液漏斗滴加浓硫酸的操作是_____________________________。
(2)将SO2气体分别通入下列溶液中:
①品红溶液,现象是_______________________________________________________;
②溴水溶液,现象是_______________________________________________________;
③硫化钠溶液,现象是_____________________________________________________。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
①原因_____________________;验证方法__________________________。
②原因_____________________;验证方法__________________________。
③原因_____________________;验证方法__________________________。
8、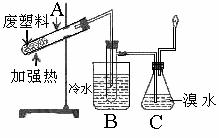 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如右图。
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如右图。
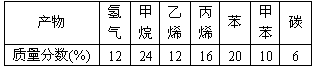 加热聚丙烯废塑料得到的产物如右表:
加热聚丙烯废塑料得到的产物如右表:
(1)试管A中残余物有多种用途,如下列转化就可可制取高聚物聚乙炔。
A中残留物聚乙炔
写出反应②~③的化学方程式 、 。
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有 种。
(3)锥形瓶C中观察到的现象 。
经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为 。
(4)写出C中逸出的气体在工业上的两种用途 、 。
7、硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸猴,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。实验步骤如下:
 (1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有 。
(a) 容量瓶 (b) 烧杯 (c) 烧瓶
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是 。
(a) 控制溶液中Fe2+与Fe3+含量比 (b) 确定下一步还原所需铁的量
(c) 确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4 + NaClO3 + 3H2SO4 → 3Fe2(SO4)3 + NaCl + 3H2O
若改用HNO3氧化,则反应方程式如下
6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + NO↑ + 4H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的得弊,利是 ,弊是 。
聚合硫酸铁溶液中SO42¯与Fe3+物质的量之比不是3:2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比。
(4)测定时所需的试剂 。
(a) NaOH (b) FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定 和 的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作 (按操作先后顺序列出)。
(a) 萃取、分液 (b) 过滤、洗涤 (c) 蒸发、结晶
(d) 冷却、称量 (e)烘干或灼烧
6、(B)某化学课外小组用右图装置制取溴苯。
先向分液漏斗中加入苯和液溴 ,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
(1) 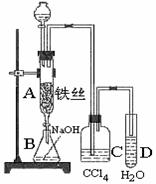 写出A中反应的化学方程式
写出A中反应的化学方程式
(2) 观察到A中的现象是 。
(3) 实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是 ,写出有关的化学方程式 。
(4) C中盛放CCl4的作用是 。
(5) 能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入 ,现象是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com