
题目列表(包括答案和解析)
1、 写出二硫化亚铁与氧气反应的方程式:
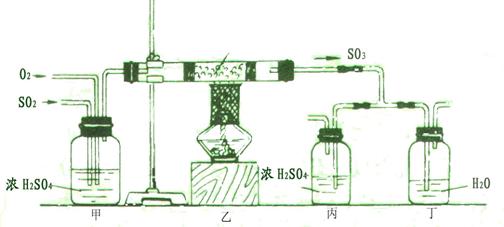
20.(16分)工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔。在沸腾炉内二硫化亚铁与氧气发生反应,生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与氧气化合,生成三氧化硫; 三氧化硫流经吸收塔时,采用98.3%的浓硫酸吸收,使三氧化硫最终与水化合形成硫酸。
下面的装置是仿照工业上制备硫酸的流程设计出来的。见下图:
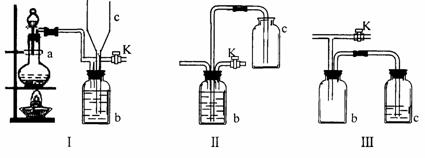
19.(8分)在实验室里制取某些有毒气体时,为了尽量防止毒气逸散造成空气污染,有人设计了如下图所示的装置[Ⅰ]。并设想用[Ⅱ]或[Ⅲ]两种简易装置代替[Ⅰ]的b-c部分,以求达到同样的目的。
试回答:
(1)若用[Ⅰ]取氯气,b瓶加入的液体一般为 ______________。在选取试剂正确且适量的前题下,反应开始后,当关闭活塞K时如若发现c中液面不明显上升,你分析可能的原因是__________________________检查的简单方法是_________________________
(2)装置[Ⅰ]中b能防止多余气体逸散的原因是:____________________________
18.(6分)水蒸气通过灼热的煤所产生的混合气,其主要成分是CO、H2、CO2和水蒸气。请用下列装置设计一个实验,以确认混合气中含有CO和H2。
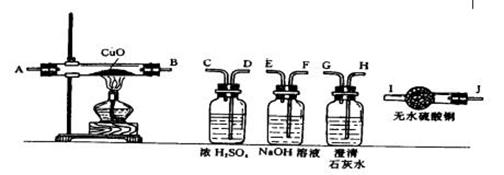
(1)连接上述装置的正确顺序是:(填各接口的代码字母)
混合气→( ) ( )接 ( ) ( )接 ( ) ( )接 ( ) ( )接 ( ) ( )。
(2)确认混合气中含有H2的实验现象是:______________;其理由是______________ 。
17.(12分) 将a mol的NH3与b mol的O2混合后,充入一密闭容器,在Pt存在下升温至700℃,充分反应后,冷却至室温。
 (1)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:
(1)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:
|
b∕a的取值范围 |
溶质 |
溶质物质的量 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(2)当a=2.00,b=4.00,在室温下得到的产物是什么?若该产物的密度为1.44g.ml-1,则其溶质的质量分数和物质的量浓度各是多少?
16.(16分)(1)2003年底,重庆发生井喷毒气伤人事件,这主要是混杂在天然气中的硫化氢(化学式 )、HCN等有毒气体使人中毒。
(2)硫和氧都是 族的元素,乙醇可以看成是水中一个H被乙基替代的衍生物,因此硫化氢中的一个H也可以被乙基替代,得到乙硫醇,其化学式为 。
(3)根据上述规律,异丙硫醇、苯硫酚的化学式分别是 和 。
(4)类似地,如果丙酮中的O被S替代,得到CH3-CS-CH3,则其命名为 ;同样,已知CH3-CO-SH命名为乙硫羟酸,则CH3-CS-OH可命名为 。
(5)苯硫酚具有比苯酚还强的酸性,则对硝基苯硫酚与氢氧化钾反应的化学方程式为:
(6)硫醇也具有一定的酸性,可以与碱反应,1mol化合物HSCH2CH(NH2)COOH能与
mol的NaOH反应。
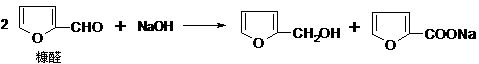
15.(16分)(1)芳香醛(如糠醛)在碱作用下,可以发生如下反应:
(2)不饱和碳碳键上连有羟基不稳定。
(3)化合物A~F之间的转化关系如下图所示。其中,化合物A含有醛基,E与F是同分异构体,F能与金属钠反应放出氢气。A生成F的过程中,A中醛基以外的基团没有任何变化。
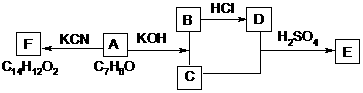
据上述信息,回答下列问题:
(1)写出A生成B和C的反应式:
(2)写出C和D生成E的反应式:
(3)F结构简式是:
(4) A生成B和C的反应是( ),C和D生成E的反应是( )
A、氧化反应 B、加成反应 C、消除反应 D、酯化反应 E、还原反应
(5)F不可以发生的反应有( )
A、氧化反应 B、加成反应 C、消除反应 D、酯化反应 E、还原反应
14.(10分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
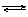 H2A=H++HA-
HA- H++A2-
H2A=H++HA-
HA- H++A2-
回答下列问题:
(1) Na2A溶液显____________(填“酸性”,“中性”,或“碱性”)。
理由是____________________________________________(用离子方程式表示)
(2) 在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式正确的是__________
A c(A2-) +c( HA-)+c( H2A) =0.1mol·L-1
B c(OH-)=c(H+) +c( HA-)
C c(Na+ )+ c(H+) =c(OH-)+ c( HA-)+2c(A2-)
D c(Na+ )= 2c(A2-) +2c( HA-)
(3) 已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能是_______0.11 mol·L-1(填“〈”,“〉”,或“=”),理由是:
____________________________________________________________
(4) 0.1mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是:
_____________________________________________________________________
13.(8分)已知甲、乙、丙是三种常见的单质,且组成它们的三种元素的核电荷数之和为35,A到H是八种常见化合物。上述各物质间的相互关系见下图所示(反应条件省略):



 产物之一
产物之一


 甲 丙 B 丙 E 水 丙
甲 丙 B 丙 E 水 丙
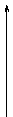






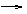
 A D 丙 G
②电
A D 丙 G
②电
解






 乙 丙 C 丙
① F 水 H溶液
乙 丙 C 丙
① F 水 H溶液
试回答:
(1)丙的化学式是__________________
(2)用电子式表示A的形成过程_____________________ _________
(3)写出①②两步的化学方程式:
①________________________________________ __
②___________________________________ _______
12.吗丁啉是一种常见的胃药,其有效成分的结构简式可用下图表示。关于该物质的下列说法不正确的是
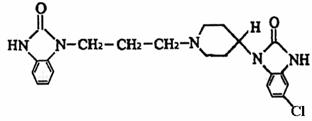
A 该物质的分子式为C22H25ClN5O2 B 该物质具有碱性,能与酸反应
C该物质不能发生水解反应 D 该物质能发生取代反应和加成反应
第II 卷
(共四大题,8小题,共92分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com