
题目列表(包括答案和解析)
36. 答案:( 1) C10H16O;
(2)将少量的柠檬醛滴入新制的氢氧化铜悬浊液(或银氨溶液)中,加热(或水浴加热)可观察到有红色的沉淀产生(或银镜产生),由此说明其分子中含有醛基。
(3)加入银氨溶液,水浴加热,加酸酸化,再加溴水,若褪色,说明含有碳碳双键。
 (4)
(4)
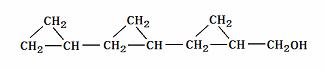
36、柠檬醛是一种用于合成香料的工业香料,经分析测定柠檬醛分子结构呈直链状,碳原子的排列方式可以划分为若干个异戊二稀分子的碳链结构,相对分子质量为152,现取1mol柠檬醛在氧气中充分燃烧,产物为CO2和H2O,且生成CO2的物质的量比H2O多2mol
试填写下列空白:
(1)柠檬醛的分子式为________________,结构简式为_________________.
(2)设计一个实验,证明柠檬醛分子结构中含有醛基(简要说明所用的试剂、实验步骤、实验和结论):______________________________________.
(3)已知溴水能氧化醛基,若要证明柠檬醛分子中含有碳碳双键,其方法是
__________________________________________________.
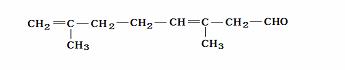 (4)柠檬醛分子有多种同分异构体,请写出属于醇类、分子结构中不含有甲基和不饱和碳原子的任意一种同分异构体的结构简式:_____________________________________.
(4)柠檬醛分子有多种同分异构体,请写出属于醇类、分子结构中不含有甲基和不饱和碳原子的任意一种同分异构体的结构简式:_____________________________________.
35、答案:①C a②D a③E d④B d⑤A c
 C6H5OH +NaOH C6H5ONa
+ H2O
C6H5OH +NaOH C6H5ONa
+ H2O
 2CH3COOH + Na2CO3
2CH3COOH + Na2CO3
 2CH3COONa + CO2 +H2O
2CH3COONa + CO2 +H2O
34、根据以下反应关系图,回答下列各问题:
 (1)A溶液中所含溶质是
、 (写化学式)。
(2)写出气体C和气体F反应的化学方程式:
(3)写出气体F与过量NaOH溶液反应的离子方程式:
34、答案:(1)Na2S
、Na2SO3
(2)SO2+2H2S==3S+2H2O
(3)SO2+2OH-==SO32-+H2O
35、为了进行I项实验,请从II项中选出一种试剂,从Ⅲ项中选出一种合适的实验操作方法,将标号填在后面的答案栏内。
(1)A溶液中所含溶质是
、 (写化学式)。
(2)写出气体C和气体F反应的化学方程式:
(3)写出气体F与过量NaOH溶液反应的离子方程式:
34、答案:(1)Na2S
、Na2SO3
(2)SO2+2H2S==3S+2H2O
(3)SO2+2OH-==SO32-+H2O
35、为了进行I项实验,请从II项中选出一种试剂,从Ⅲ项中选出一种合适的实验操作方法,将标号填在后面的答案栏内。
|
I实验 |
II试剂 |
Ⅲ操作方法 |
答案 |
||
|
I |
II |
Ⅲ |
|||
|
①除去苯中的苯酚 |
A、溴水 B、水 C、氢氧化钠溶液 D、氧化钙 E、碳酸钠溶液 |
a、蒸馏 b、过滤 c、洗气 d、分液 e、渗析 |
① |
|
|
|
②除去工业酒精中的水 |
② |
|
|
||
|
③除去乙酸乙酯中的乙酸 |
③ |
|
|
||
|
④除去溴乙烷中的乙醇 |
④ |
|
|
||
|
⑤除去甲烷中的乙烯 |
⑤ |
|
|
写出①和③中发生反应的化学方程式:
____________________________________________________________________________
___________________________________________________________________________。
33. 答案: (1)加热,常温下浓HNO3会使铁的表面氧化形成致密的氧化膜,阻止了反应进一步进行,表现为“钝化”
(2)3NO2+H2O====2HNO3+NO 2NO+O2====2NO2
(3)白色沉淀变为灰绿色,最终变为红褐色 4Fe(OH)2+O2+2H2O====4Fe(OH)3
33. 如下图,A、B是中学化学里常用的物质,已知A是化合物,B是单质;E溶液中滴入KSCN溶液呈红色。试回答:
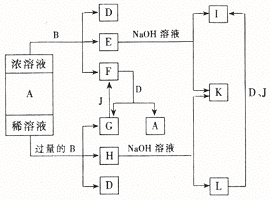
(1)B和A的浓溶液反应的条件是 ,简述常温下不易反应的原因 。
(2)写出F和G相互转化的化学方程式
F→G 。
G→F 。
(3)简述L转化为I的现象 ,该反应的化学方程式为 。
32.制溴化亚铁可用以下装置:装置中a是一支瓷管,b是一只套住瓷管的电炉,c是两只耐高温的瓷舟(瓷舟内共盛有56 g的铁粉),d和e中的液体均为液溴。
实验开始时,先将瓷管加热至600℃-700℃,再用干燥的CO2气流将装置里的空气排净后继续缓慢地输进瓷管,最后溴从d中慢慢滴入已加热至100℃-120℃的e中,经过几个小时的反应,在瓷管的一端沉积着黄绿色鳞片状的
FeBr2 80 g。试回答下列问题:
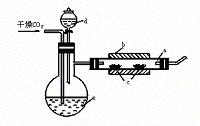
(1)如何检查用塞子(插有导管和仪器d)塞紧的e(未与瓷管连接)的气密性 。
(2)如果导入装置里的CO2没有干燥,就会发生副反应,该反应的化学方程式是 。
(3)瓷管两端的塞子,适宜于选用 作材料最佳,其理由是 。
A.橡皮 B.石棉 C.玻璃 D.软木
|
①是 ;②是 。
(5)根据反应方程式:2Fe+3Br2====2FeBr3
2FeBr3====2FeBr2+Br2↑求得这次实验中FeBr2的产率是 。
(6)为了防止污染空气,在装置最后应 。
32答案.(1)关闭活塞,在支管口与导管口各连接一段橡皮管并浸入水中,两手紧贴容器外壁(或酒精灯微热),若橡皮管口有气泡冒出,证明不漏气
|
(3)B 石棉耐高温,且溴不腐蚀石棉
(4)①使溴挥发逸出进入a管 ②将装置里的空气排尽,防止铁在高温下被氧化
(5)37%
(6)将尾气通入盛有NaOH溶液的烧杯中
31、已知四种物质在水中、液氨中的溶解度(g溶质/100 g溶剂)如下表:
|
溶质 溶剂 |
AgNO3 |
Ba(NO3)2 |
AgCl |
BaCl2 |
|
水 |
170 |
9.3 |
1.5×10-4 |
33.3 |
|
液氨 |
86 |
97.2 |
0.8 |
0 |
(1)分别是1.0 mol· L-1的Ag+、Ba2+、NO-3和Cl-在水中发生反应的离子方程式是 。
(2)分别是0.50 mol·L-1的以上四种离子在液氨中发生反应的离子方程式是
。
(3)得出以上结论的依据是 。
(4)将以上四种离子按适当浓度混合于液氨之中,能否有AgCl沉淀析出?
答:________(“能”或“否”)。
31答案:(1)Ag++Cl-====AgCl↓ Ba2++2NO ====Ba(NO3)2↓
====Ba(NO3)2↓
(2)Ba2++2Cl-====BaCl2
(3)溶液中复分解反应发生的条件之一是有沉淀生成,而溶解度小者首先形成沉淀析出
(4)能
30、利用下列装置进行实验,可证明碳和浓硫酸反应放出的气体。已知左图中4个洗气瓶均装有检测液,现给出4种溶液:①酸性高锰酸钾溶液;②品红溶液;③澄清石灰水;④浓硫酸。
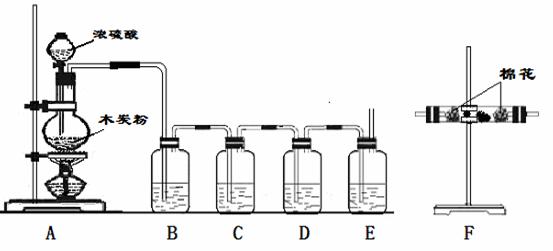 (1)写出木炭粉和浓硫酸反应的化学方程式:___________________。
(1)写出木炭粉和浓硫酸反应的化学方程式:___________________。
(2)试指出B、C、D、E各洗气瓶所盛液体的名称和作用。
B.__________________,______________________________________
C.__________________,_____________________________________
D.__________________,_____________________________________
E.__________________,______________________________________。
(3)上述装置只能证明木炭粉和浓硫酸反应生成的部分气体,为了验证生成的另一种物质可在_____________装置之间连接F装置,F装置所盛有的试剂是____________,其现象是_______________________________。
________________________________________________。
30 答案:(1)C +2H2SO4(浓)=====CO2↑+2SO2↑+2H2O
(2)B:品红溶液,证明生成了SO2;
C:酸性高锰酸钾,除去SO2;
D:品红溶液,检验SO2是否除尽;
E:澄清石灰水,证明CO2的存在。
(3)AB;无水CuSO4;无水CuSO4变蓝。
29. 在热的稀硫酸中溶解了22.8 g硫酸亚铁,当加入100 mL 0.50 mol·L-1硝酸钾溶液时,其中的亚铁离子完全转化为铁离子,并有氮氧化物逸出:
____FeSO4+___KNO3+ _____ ___K2SO4+___Fe2(SO4)3+___NaOb↑+___H2O
___K2SO4+___Fe2(SO4)3+___NaOb↑+___H2O
(1)配平该化学方程式(将含a、b的计量数和所缺物质填在横线上)
(2)反应中起氧化作用的物质是________(写化学式)
(3)推算出a、b的数值:a=________,b=________。
29答案:(1)6 2 4H2SO4 1 3 2/a 4
(2)HNO3(答NO 或KNO3亦可)
或KNO3亦可)
(3)1 1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com