
题目列表(包括答案和解析)
41、答案:(1)①2SO2+O2+2CaCO3==2CaSO4+2CO2或
2SO2+O2+2CaCO3+2H2O ==2 [CaSO4·2H2O]+2CO2或
SO2+CaCO3==CaSO3+CO2
2CaSO3+O2==2CaSO4
②2SO2+O2+2Ca(OH)2==2CaSO4+2H2O或
2SO2+O2+2Ca(OH)2+2H2O ==2 [CaSO4·2H2O]或
SO2 +Ca(OH)2==CaSO3+H2O
2CaSO3+O2==2CaSO4
(2)氢氧化钙微溶于水,澄清石灰水中氢氧化钙的浓度小,尽管它是饱和的,不利于SO2的吸收。
(3)不可取,因为SO2的排放总量没有减少,进一步形成酸,仍会造成对全球环境污染。
41、已知:氢氧化钙在水中存在下列溶解平衡:Ca(OH)2(固) Ca2++2OH-在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等,为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
(1)写出上述两个反应的化学方程式:
①SO2与CaCO3悬浊液反应:
_______________________________________________________________
②SO2与Ca(OH)2悬浊液反应:
________________________________________________________________
(2)试说明用熟石灰的悬浊液,而不用澄清石灰水洗涤废气的理由:
(3)在英国进行的一个研究结果表明:高烟囱可以有效地降低地表面SO2浓度。在20世纪的六、七十年代的十年间,由发电厂排放的SO2增加了35%,但由于建造高烟囱的结果地面浓度降低了30%之多,请你从全球环境保护的角度,分析这种方法是否可取?
答:___________________________________________________
40、答案:,A:CuSO4 D:CuSO4 F:SO3
2Cu +O2+2H2SO4==2 CuSO4+2H2O
40、A→F均为中学化学中常见的物质,它们之间相互转化的关系如下:
(1)写出下列物质的化学式:A_________;D___________;F__________.
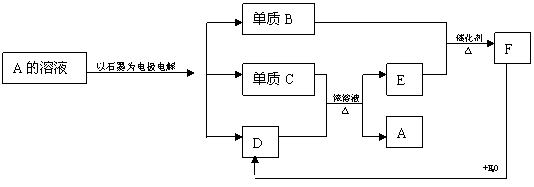
(2)C与D的稀溶液不反应,但若加入B在加热条件下可以反应生成A,试写该反应的化学方程式:________________________________________.
(3)从下列仪器中选出实验所需仪器(用字母填写)____________,还需要的仪器是
______________.
A、托盘天平 B、研钵 C、试管夹 D、酒精灯 E、蒸发皿
F、玻璃棒 G、坩埚 H、干燥器 I、石棉网 J、三角架
(4)有下列情况对实验结果造成的误差是偏高、偏低或不影响?
(a)在空气中冷却( ) (b)坩埚不干燥( )
(c)坩埚不洁净附有不分解的污物( ) (d)硫酸铜晶体含有不分解的杂质( )
(5)若坩埚的质量为m1g,CuSO4·xH2O晶体质量为m2g,失水后,坩埚和白色粉末的质量为m3g,则x值为:_______________(用含m1、m2、m3表达式表示)
39、答案:(1)(2)(3)略(4)根据W(结晶水)=m(结晶水)/m(硫酸铜晶体),而m(结晶水)=灼烧前后的质量差(即失重),根据数学表达式分析:a、空气中冷却无水硫酸铜会吸收空气中的水分而使失重量减少,故偏低;b、坩埚不干燥失重量偏大、结果偏高;c、坩埚不结净附有不分解的污物,已计入坩埚的质量对失重无影响,所以不影响实验结果;d、因晶体中含有不分解的杂质,失重比纯净的硫酸铜晶体失重要小,故偏低。
39、测定硫酸铜晶体中结晶水的含量,至少要在天平上进行四次称量。
(1)第一次做_________的称量:第二次做__________的称量;第三次做_________的称量;第四次做___________的称量。
38、答案:(1)TiO2 (2)B(3)钝化(4)TiCl4+2H2O=TiO2+4HCl(5)AB
(6)BC(7)①TiO2+2Cl2+2C=TiCl4+4CO② TiCl4+2Mg=2MgCl2+Ti
38、金属钛由于在许多方面的优良性能,正日益广泛地
应用于空间技术、航海、化工和医疗等诸多领域,
钛在自然界中存在的一种矿物叫金红石,金红石的
晶体结构如右图所示。
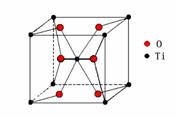 (1)按金红石的晶体结构示意图可推知金红石的组成为
(1)按金红石的晶体结构示意图可推知金红石的组成为
______________________________.
(2)钛在地壳中广泛分布,占地壳质量的0.42%,在所有元素中居第九位,比碳、锰、铜、锌都要多,但由于提取上的困难,直至1790年才被发现,因此可知:钛是__________.
A、较稳定的金属 B、较活泼的金属
C、资源丰富,但极为分散 D、在地壳了储量较少,容易制取单质
(3)钛及钛合金具有极强的抗腐蚀能力,浸于海水中的钛,十年无锈斑,因此被用于制造轮船、潜艇和重要的化工设备,钛的这一性质是由于在表面形成致密的氧化物保护膜而使金属钛___________.
(4)TiO2是极稳定的化合物,冶铁金属钛的中间产物TiCl4会因水解而生成TiO2,其水解反应的化学方程式可写成______________________________________________.
(5)钛被称为“生物金属”,用于医疗上接骨和制造人工关节,新的骨骼和肌肉可以在钛的表面生长,所以钛是比不锈钢性能优良的生物医学功能材料。因此可推测金属钛在生物医学上这些用途是因为钛具有____________的性质。
A、钛的密度与人体骨骼密度接近 B、钛的抗腐蚀性能好,不被人的体液腐蚀
C、金属钛的来源广泛,价格便宜 D、金属钛的储量丰富,冶炼容易
(6)钛被为“航天金属”,被广泛用于制造航空航天飞行器的结构材料,下列说法中正确的是_____________.
A、钛的密度比铁、铝的密度都小 B、钛有很高的熔点,不易被熔化
C、钛有很高的熔点,不易被熔化 D、钛比铁、铝的来源广泛,更易获得
(7)金属钛的冶炼主要分为两点:①在高温环境下,将TiO2在有炭粉存在的条件下用Cl2处理,在高温下得到TiCl4;②用镁(或钠)在高温下和氩气存在的气氛中还原TiCl4而制得金属钛,上述两步反应的化学方程式:
①____________________________________________________,
②____________________________________________________.
37、答案:(1)饱和NaHCO3溶液、分液;(2)NaOH溶液,Na2CO3溶液,蒸馏。
37、醛可以跟亚硫酸氢钠饱和溶液发生加成反应,生成物是水溶性的α-羟基磺酸钠:
R-CHO+NaHSO3 R-CH(OH)-SO3Na
反应是可逆的,在通常条件下有70%-90%向正方向转化:
(1)若氯苯中混有杂质苯甲醛,欲将此杂质全部除去,可采用的试剂是__________,其分离方法_________________________________________.
(2)若使CH3CH(OH)-SO3Na全部变成乙醛,可采用的试剂是___________或_______,其分离方法_______________________________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com