
题目列表(包括答案和解析)
26.(8分)(1)c(HCl)=1000×1.18×36.5%÷36.5 =11.8mol·L-1(3分)
(2)n(HCl)=11.8×0.0254=0.300mol
n(NaOH)=2.00×0.01=0.200mol (3分)
pH=1g(0.300-0.200)/1=1 (2分)
25.(10分)(每空2分,共10分)(1)CH3CH2CH2Br;CH3CH2CH2OH;CH3CH2CHO
 (2)CH3CH2CH2Br+NaOH
CH3CH2CH2OH+NaBr
(2)CH3CH2CH2Br+NaOH
CH3CH2CH2OH+NaBr
 (或CH3CH2CH2Br+H2O+H2O
CH3CH2CH2OH+HBr)
(或CH3CH2CH2Br+H2O+H2O
CH3CH2CH2OH+HBr)
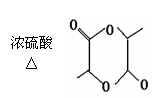
 2CH3CH2COOH +2H2O
2CH3CH2COOH +2H2O
|
OH
24.(8分)(1)C16H16O2 (2)
|
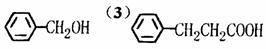
23、(12分)分析:正盐A能与强酸反应生成气态氢化物,则A中含无氧酸根即非金属阴离子。该非金属单质可被O2连续两次氧化,分别生成两种氧化物,故A中含S2-。其转化过程是:
S2-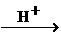 H2S
H2S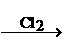 S
S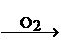 SO2
SO2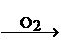 SO3
SO3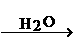 H2SO4。
H2SO4。
又因为正盐A能与强碱反应生成气态氢化物,则A中含NH4+。气态氢化物NH3中氮被Cl2置换后生成的HCl又与NH3化合成NH4Cl。其转化过程是:
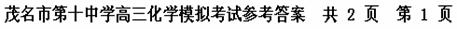 NH4+
NH4+ NH3
NH3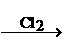 N2
N2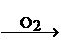 NO
NO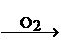 NO2
NO2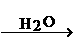 HNO3。
HNO3。
答案:(1)(NH4)2S;(2)H2SO4 ;(3)HNO3;(4)H2S+Cl2=2HCl+S↓, 8NH3+3Cl2=N2+6NH4Cl
22.(10分)(每空2分,共10分)(1)  三角锥形
三角锥形
|
|||
|
|||
(2)2Mg+CO2 2MgO+C; 4NH3+5O2
4NO+6H2O
|
(3)NH4++HCO3-+2OH-+2OH NH3↑+CO +2H2O
+2H2O
21.(14分)(1)不支持 FeO有还原性,SO3有氧化性,受热时要发生氧化还原反应(3分)
(2)①在C装置的导管出口处有刺激性气味 (2分)
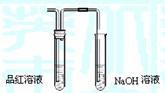 ② Fe2O3
SO3
(各2分)
② Fe2O3
SO3
(各2分)
③
(3分)(其他合理答案同样给分)
④2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O(2分)
Fe2O3+SO2↑+SO3↑+14H2O(2分)
20.(8分)(1)蓝色硫酸铜晶体完全变成白色粉末 4
(2)硫酸根离子对铝与氢离子的反应有抑制作用等 在铝与盐酸的反应溶液中,加入Na2SO4固体,观察反应速率是否减慢(其他合理答案同样给分) (各 2分)
27.(12分)中学教材上有如下介绍:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。有两个实验小组的同学决定通过实验探究碱石灰的组成。
(1)第一小组设计方案的流程如下:

①写出n(OH-)、n(Ca2+)和n(Na+)的关系:n(Na+)=________________________。
②设n(Na+)=xmol、n(Ca2+)=ymol,请填写下表:
|
碱右灰的 可能组成 |
NaOH、CaO |
NaOH、CaO、Ca(OH)2 |
NaOH、Ca(OH)2 |
NaOH、Ca(OH)2、H2O |
|
n(Na+)和n(Ca2+) 的关系 |
40x+56y=0.4 |
|
|
|
(2)第二小组同学查得如下资料:Ca(OH)2在250℃时不分解、NaOH在580℃时不分解。他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.6g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.7g。请通过计算确定该碱石灰各成分的质量分数。
高 考 模 拟 考 试
化学参考答案
26.(8分)右图为某市售盐酸试剂瓶标签上的部分数据。问:
(1)该盐酸的物质的量浓度为多少?(列式计算)
(2)取该盐酸25.4mL与2.00mol/L的氢氧化钠溶
液100mL混合,再将混合后溶液稀释至1.00L,
此时溶液的pH约为多少?
25.(10分)已知羧酸在磷的催化条件下可以和卤麦反应生成α-卤代物(与羟基相邻的碳原子上的氢原子被取代):
P
 RCH2COOH+Cl2
RCHCOOH+HCl
RCH2COOH+Cl2
RCHCOOH+HCl
|
Cl
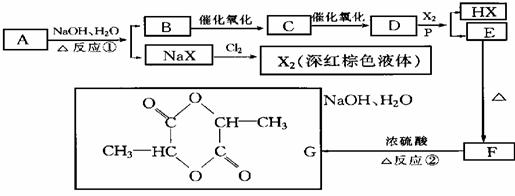
(1)写出有机物A、C、D的结构简式:
A. ,C. ,D. 。
(2)写出下列反应的化学方程式:
反应①: 。
反应② 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com