
题目列表(包括答案和解析)
2.下列物质存放方法正确的是( )
A.药品柜的同一层不可存放浓硝酸和浓氨水 B.少量的钠保存在无水乙醇中
C.少量白磷保存在二硫化碳中 D.硅酸钠溶液保存在玻璃塞的试剂瓶中
1.用铜锌合金制成的假金元宝欺骗行人的事件屡有发生下列不易区别其真伪的方法是
A.测定密度 B.放入硝酸中 C.放入盐酸中 D.观察外观
37.现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1摩,在此溶液中加入90毫升4摩/升的NaOH溶液,使其充分反应.设Al3+物质的量与总物质的量的比值为x.
(1)根据反应的化学方程式计算x=0.4时,溶液中产生的沉淀是什么?物质的量有多少?
(2)计算沉淀中只有Fe(OH)3的x取值范围.
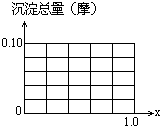 请在下图中画出沉淀总量(摩)随x(0→1)变化的曲线.
请在下图中画出沉淀总量(摩)随x(0→1)变化的曲线.
(3)若Al3+和Fe3+物质的量之和为A摩(A为合理数值),其他条件不变时,求沉淀中同时有Fe(OH)3、Al(OH)3的x取值范围和各沉淀的物质的量(用含有A、x的式子表示).
36.六价铬对人体有毒,含铬废水要经化学处理后才能排放,方法是用绿矾(FeSO4·7H2O)把废水中的六价铬还原为三价铬离子,再加入过量的石灰水,使铬离子转变为氢氧化铬Cr(OH)3沉淀.其主要反应的化学方程式如下:
H2Cr2O7+6FeSO4+6H2SO4=3Fe2(SO4)3+Cr2(SO4)3+7H2O
现用上法处理1×104升含铬(+6价)78毫克/升的废水(Cr相对原子质量52),试回答:
(1)处理后,沉淀物中除Cr(OH)3外,还有 、 (用化学式表示).
(2)需用绿矾多少千克?
的结构简式:
(2)现有下列A、B两组物质:
A组:CH3-CHCl-CH3、、HCOOH、CH3COOC2H5
B组:CH3CH2OH、银氨溶液、NaOH水溶液、NaOH醇溶液
试回答:A组中 能跟B组中所有物质在一定条件下发生反应,其中属于酯化反应的化学方程式为 ;
B组中某物质跟A组中某物质发生消去反应的化学方程式为 .
35.有机物A、B、C中碳、氢、氧三元素物质的量之比均为1:2:1,它们都能发生银镜反应,但都不能发生水解反应.B1、B2是B的同分异构体.又知:
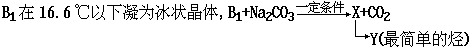
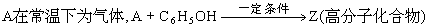
B2为无色液体,也能发生银镜反应;
1摩C完全燃烧需要3摩氧气.
试回答:(1)B2的名称 ,A、B的结构简式:A 、B ;
(2)写出X→Y的化学方程式: ;
(3)C的结构简式 ,与C互为同分异构体,且属于乙酸酯类化合物的结构简式 , .
33.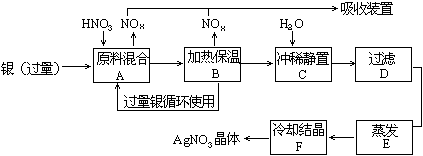 某试剂厂用银(含杂质铜)和硝酸(含杂质Fe3+反应制取硝酸银.步骤如下:
某试剂厂用银(含杂质铜)和硝酸(含杂质Fe3+反应制取硝酸银.步骤如下:
依据上述步骤,完成下列填空:
(1)溶解银的硝酸应该用 硝酸(填浓或稀).原因是 .
(a)减少过程中产生NOx的量
(b)减少原料银的消耗量
(c)节省硝酸物质的量
(2)步骤B加热保温的作用是 .
(a)有利于加快反应速度
(b)有利于未反应的硝酸挥发
(c)有利于硝酸充分反应,降低溶液中[H+]
(3)步骤C是为了除去Fe3+、Cu2+等杂质.冲稀静置时发生的化学反应是 ;
(a)置换反应 (b)水解反应 (c)氧化-还原反应
产生的沉淀物化学式: .
32.实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:
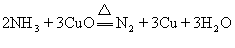
试回答:(1)如果选用测定反应物CuO和生成物H2O的质量(mCuo、
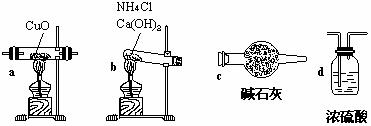
①仪器连接的顺序(用字母编号表示,仪器可重复使用) ;
d中浓硫酸的作用是 , ;
实验完毕时观察到a中的现象是 ;
②列出计算Cu的相对原子质量的表达式 ;
③下列情况将使测定结果偏大的是 .(以下选择填空不限1个正确答案,均用字母编号填写)
(a)CuO未全部还原为Cu (b)CuO受潮
(c)CuO中混有Cu
(2)如果仍采用上述仪器装置,其他方案可选用测定的物理量有


31.(B)(1)为防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用.请写出燃烧时,有关"固硫"(不使硫化合物进入大气)反应的化学方程式:
,
 (2)近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,其反应的化学方程式为:NH3+HClO H2O+NH2Cl(一氯氨).NH2Cl较HClO稳定.试分析加液氨能延长液氯杀菌时间的原因:
.
(2)近年来,某些自来水厂在用液氯进行消毒处理时还加入少量液氨,其反应的化学方程式为:NH3+HClO H2O+NH2Cl(一氯氨).NH2Cl较HClO稳定.试分析加液氨能延长液氯杀菌时间的原因:
.
31.(A)化合物E(含两种元素)与NH3反应,生成化合物G和H2.化合物G的相对分子质量约为81,G分子中硼元素(B相对原子质量为10.8)和氢元素的质量百分含量分别是40%和7.4%由此推断:
(1)化合物G的分子式为 ;
(2)反应消耗1摩NH3,可生成2摩H2,组成化合物E的元素是 和 ;
(3)1摩E和2摩NH3恰好完全反应,化合物E的分子式为 .
30.(B)下列反应在210℃达到平衡:
PCl5(气) PCl3(气)+Cl2(气)-Q1 K=1 ①
 CO(气)+Cl2(气) COCl2(气)+Q2 K=5x104 ②
CO(气)+Cl2(气) COCl2(气)+Q2 K=5x104 ②
COCl2(气) CO(气)+Cl2(气)-Q2 ③
(1)根据反应①的平衡常数K表达式,下列等式必定成立的是
(a)[PCl5]=[PCl3]=[Cl2]=1
(b)[PCl5]=[PCl3][Cl2]=1
(c)[PCl5]=[PCl3][Cl2]
反应②和反应③的平衡常数K表达式 (填"相同"或"不同");
(2)降低Cl2浓度,反应③的K值 (填"增大"、"减小"或"不变");
(3)要使反应①和反应②的K值相等,应采取的措施是 .
(a)反应①、反应②同时升高温度
(b)反应①、反应②同时降低温度
(c)反应①降低温度,反应②维持在210℃
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com