
题目列表(包括答案和解析)
5.接触法制硫酸中,最后的产品是98%硫酸或20%发烟硫酸(可看作H2SO4和SO3的混合物,其中SO3的质量分数为20%)。
⑴若98%硫酸可表示为SO3·aH2O,20%发烟硫酸可表示为H2O·bSO3,则a、b的值(可用分数表示)分别是a= b=
⑵用m(H2O)=k×n(SO3)分别表示SO3转化成上述两种硫酸时,所用水的质量与SO3的物质的量的关系式分别是m1(H2O)= n1(SO3)、m2(H2O)= n2(SO3)。
⑶若工厂同时生产上述两种硫酸,则两种产品的质量比x(x=W1/W2,W1:98%硫酸的质量、W2:20%发烟硫酸的质量)与SO3用量之比的关系式是:n1(SO3)/ n2(SO3)= x。
硫酸的混合
4.H2SO4是SO3的水合物,设某种(90%)浓H2SO4存在着三种水合物形式:H2SO4(SO3·H2O),H2S2O7(2SO3·H2O),H2SO4·2H2O(SO3·3H2O),若H2SO4·2H2O的质量占了一半,那么H2SO4和H2S2O7的物质的量的比是 ( )
A.1:1 B.98:168 C.163:191 D.168:191
3.将三氧化硫溶解在硫酸中所得到的混合物叫做“发烟硫酸”,通常以发烟硫酸中三氧化硫的质量分数表示其组成。今将0.1185g发烟硫酸试样溶于水,用0.125 mol/L 的NaOH标准溶液滴定。用去此标准溶液20mL恰好中和,则试样中SO3的质量分数为 ( )
A.15% B.17% C.34% D.60%
2.用浓H2SO4吸收SO3可以得到H2SO4·SO3,若用1000g98%的H2SO4充分吸收SO3后,再进行稀释,可得到98%的硫酸的质量是多少千克?
1.现有1L含SO3为30%的发烟硫酸(密度为1.95g/cm3),要把它稀释成浓度为95%的浓硫酸,要加水约为 ( )
A.120mL B.180mL C.240mL D.300mL
3.三位学生设计了下述三个方案,并都认为,如果观察到的现象和自己设计的方案一致,即可确证试液中有SO42-。
方案甲:试液
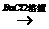 白色沉淀
白色沉淀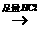 沉淀不溶解;
沉淀不溶解;
方案乙:试液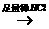 无沉淀
无沉淀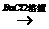 白色沉淀;
白色沉淀;
方案丙:试液 无沉淀
无沉淀
 白色沉淀
白色沉淀
试评价上述各方案是否严密,并分别说明理由: 。
发烟硫酸的组成及稀释问题
2.能够确定一种溶液中一定含有SO42-离子的事实是 ( )
A.取少量试液,加入用盐酸酸化的BaCl2溶液,有白色沉淀生成;
B.取少量试液,加入BaCl2溶液,有白色沉淀生成,再加稀HNO3,沉淀不消失;
C.取少量试液,加入Ba(NO3)2溶液,有白色沉淀生成;
D.取少量试液,加入Ba(NO3)2溶液,有白色沉淀生成,在过滤所得的沉淀中加盐酸,沉淀不溶解;
1.有一包固体混合物,由Ba(NO3)2、CaCO3、Na2S、CuSO4、BaCl2中若干种均匀混合而成,有关实验过程及记录如下:
(1)将粉末溶于水,得到蓝色溶液和白色沉淀,后将沉淀洗涤、烘干、称量质量为mg。
(2)向滤出的沉淀中加入盐酸,沉淀不溶解。
(3)把滤液分成三等份。第一份加稀硝酸和硝酸银溶液,无大量白色沉淀生成;第二份加入稀硫酸,无明显现象;第三份加入过量硝酸钡溶液,有白色沉淀生成,把沉淀滤出后洗涤、称量质量为mg。
试判断此白色沉淀的组成及它们的物质的量之比。
5.如图所示,小试管内盛有约3mL饱和硫酸铜溶液,与锥形瓶连通的U型管内盛有少量水(为便于观察,预先染成红色),沿小试管的内壁小心地慢慢倒入约3mL浓硫酸,静置片刻。可观察所到的现象有(填标号,有多少个就填多少个) 。
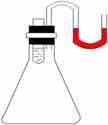 A.小试管内液体分成两层,上层蓝色,下层无色;
A.小试管内液体分成两层,上层蓝色,下层无色;
B.U型细管内左边液面下降,右边液面升高;
C.有少量白色固体析出;
D.以上现象都没有,无明显变化;
|
硫酸盐及硫酸根离子的检验 |
4. 下列各叙述中说明硫酸具有什么性质,请填空:
⑴敞口放置于空气中的浓硫酸会增重; ⑵浓硫酸与食盐共热来制取氯化氢;
⑶用铁、铝金属容器可以运输浓硫酸; ⑷用浓硫酸和硝石反应制取HNO3;
⑸浓H2SO4与Cu反应制取SO2; ⑹新制的Cl2通过浓硫酸;
⑺浓H2SO4、浓HNO3与苯制取硝基苯; ⑻淀粉与稀硫酸溶液加热;
⑼浓硫酸与苯反应; ⑽浓硫酸与乙醇共热制取乙烯;
⑾浓硫酸滴在湿润紫色石蕊试纸后,观察到先变红后变黑的现象;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com