
题目列表(包括答案和解析)
1.38.4mgCu与适量浓HNO3反应,Cu全部作用后,共收集到22.4mL(标况)气体,反应消耗HNO3的物质的量可能是 ( )
A.1.0×10-3 mol B.1.6×10-3 mol C.2.2×10-3 mol D.2.4×10-3 mol
问:气体的平均摩尔质量为 g/mol?NO3-减少的物质的量为 mol?H+减少的物质的量为 mol?
2.在某稀溶液中含有1molKNO3和4mol H2SO4,向其中加入1.5mol Cu粉,充分反应后产生的气体在标准状况下的体积为 ( )
A.11.2L B.22.4L C.33.6L D.22.4L~33.6L之间
(3)Cu和浓HNO3反应的计算
1.在某100mL混合液中,HNO3和H2SO4的物质的量浓度分别为0.4mol/L和0.1mol/L。向该混合液中加入1.92gCu粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度(mol/L)是 ( )
A.0.15 B.0.225 C.0.35 D.0.45
2.某金属单质跟一定浓度的HNO3反应,假定只有单一还原产物,当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是 ( )
A.NO2 B.NO C.N2O D.N2
(2)不活泼金属与HNO3、H2SO4混酸反应的分析与计算
1.某单质跟浓硝酸反应时,每有0.25mol单质反应就消耗1molHNO3,则单质元素氧化
后的化合价可能是 ( )
A.+1 B.+2 C.+3 D.+4
硝酸的性质
1.
计算
(1)电子守恒法确定还原产物
2.硝酸的工业制备:
原理:4NH3+5O2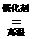 4NO+6H2O;2NO+ O2= 2NO2;3NO2+ H2O=2 HNO3 +NO
4NO+6H2O;2NO+ O2= 2NO2;3NO2+ H2O=2 HNO3 +NO
尾气吸收:NO2和NO NO2+NO+2NaOH=2NaNO2+ H2O消除对大气的污染
当V(NO2)∶V(NO)≥1∶1时,尾气可全部被吸收;当NO过量时,应先补充适量的O2;
1. 硝酸化学性质:
①强酸性:稀硝酸+石蕊试液 先变红后褪色
 a.硝酸浓度越大越易分解,致使浓硝酸呈黄色;
a.硝酸浓度越大越易分解,致使浓硝酸呈黄色;
②不稳定性:注意 b.区别浓硝酸与浓盐酸呈黄色的不同原因;
c.硝酸挥发性和不稳定性的区别
HNO3 a.大多数金属(除Au、Pt外)+ HNO3(无论浓稀)=高价态
a.大多数金属(除Au、Pt外)+ HNO3(无论浓稀)=高价态
金属硝酸盐+氮氧化合物*

b.常温下使Fe、Al钝化;
③强氧化性
c.与非金属(S、C、P等)反应
d.与其他还原性物质反应:H2S、FeS、SO2、Na2SO3、KI、HBr、HI
e.王水:V(浓HNO3)∶V(浓HCl)=1∶3
*金属与硝酸反应的一般规律:(硝酸既做氧化剂,又做酸)
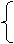 NO2(浓HNO3)
NO2(浓HNO3)
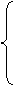 氢以后的金属+ HNO3 = 硝酸盐+
氢以后的金属+ HNO3 = 硝酸盐+
NO(稀HNO3)
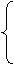 硝酸
NO2(浓HNO3)
硝酸
NO2(浓HNO3)
NO(稀HNO3)
活泼金属(氢以前)+ HNO3 = 硝酸盐+ NH4 NO3(极稀HNO3)
H2(极稀HNO3)

稀硝酸与变价金属铁反应的情况(产物与量有关):
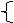 3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O
Fe+4HNO3(稀)= Fe(NO3)3+NO↑+2H2O
n(Fe):n(HNO3)≥3:8时产物为Fe2+
n(Fe):n(HNO3)≤2:8时产物为
2:8<n(Fe):n(HNO3)<3:8时产物为Fe2+与Fe3+;
3. 有关计算
2. 硝酸的工业制备
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com