
题目列表(包括答案和解析)
2.
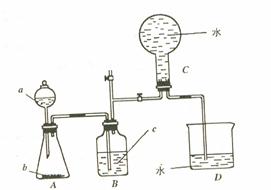 下图所示装置是某种气体X的发生装置和收集装置(必要时可加热)。所用的试剂从下列试剂中选取2~3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀硝酸、浓盐酸、蒸馏水。请回答下列问题:
下图所示装置是某种气体X的发生装置和收集装置(必要时可加热)。所用的试剂从下列试剂中选取2~3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀硝酸、浓盐酸、蒸馏水。请回答下列问题:
⑴气体X的化学式是
⑵所选药品a是 ,b是 ,装置B的作用是 。
⑶用所选药品发生反应生成X时,离子方程式是 。
⑷在反应刚开始时A中的主要现象是 。
1.用如下图所示的简易装置可以进行气体的发生和收集。
⑴实验前应如何检查装置的气密性?
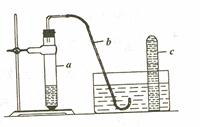 ⑵拔开试管a的橡皮塞,加入10mL6mol/L稀硝酸和1g薄铜片,立即将带有导管的橡皮塞塞紧试管口。反应开始时速率缓慢,逐渐加快。请写出在试管a中发生的所有反应的化学方程式。
⑵拔开试管a的橡皮塞,加入10mL6mol/L稀硝酸和1g薄铜片,立即将带有导管的橡皮塞塞紧试管口。反应开始时速率缓慢,逐渐加快。请写出在试管a中发生的所有反应的化学方程式。
3.某化肥厂用NH3制HNO3再进一步制NH4NO3。已知:由NH3制HNO3的产率88%;
由NH3与HNO3反应制NH4NO3时的产率为98%;若用100tNH3制NH4NO3时,用于制
HNO3的氨为 53.2 t,可制出NH4NO3 215.9 t。
实验
2.如果化肥厂用NH3制NH4NO3,已知由氨制成NO的产率96%,由NO制成硝酸的产率是92%,利用反应NH3+HNO3=NH4NO3。则制HNO3所用去的NH3质量占总消耗NH3的质量分数为 53.1%
1.氨氧化制硝酸时,如果由氨制成NO的产率96%,由NO制成硝酸的产率是93%。10t
氨可制备多少吨50%的硝酸?(答案:65.46吨)
2.铁在热的稀硝酸中反应,其主要还原产物为N2O,而在冷的稀硝酸中反应,其主要还原产物为NO,当溶液更稀时,其主要还原产物是NH4+。请分析下图,回答有关问题:
(5)硝酸工业制备中的多步计算
1.将8.4gFe溶于一定量稀硝酸中,完全反应后,n(Fe2+)=n(Fe3+),则稀硝酸中含HNO3( )
A.0.125mol B.0.25mol C.0.375mol D.0.5mol
4.将agCu投入一定浓度的硝酸溶液中,反应中消耗HNO3为bg,若a:b=8:21,则反应中起酸作用的HNO3质量为 ( )
A.b/2g B.2bg C.3a/4g D.3b/4g
(2004年高考天津卷29)
将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
⑴NO的体积为5.8L,NO2的体积为5.4L。
⑵待产生的气体全部释放后,向溶液中加入VmLamol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为(aV•10-3+0.5)/0.14mol/L。
⑶欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水57.8g。
(4)Fe与稀HNO3反应的分析与计算
3.25.6mgCu能恰好与含1.4×10-3 mol HNO3的浓硝酸完全反应,使生成的气体溶于水,最终得到的气体在标况下的体积为 L
2.0.03molCu完全溶于HNO3,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05mol,求混合气体的平均摩尔质量 ( )
A.30 B.46 C.50 D.66
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com