
题目列表(包括答案和解析)
36.(1) 金刚石
金刚石属原子晶体,而固体C60不是,故金刚石熔点较高。(答出“金刚石属原子晶体”即给分) (2)
可能 因C60分子含30个双键,与极活泼的F2发生加成反应即可生成C60F60 (只要指出“C60含30个双键”即给分,但答“因C60含有双键”不给分)
(3) 通过计算,确定C60分子所含单质数。依题意,C60分子形成的化学键为: =90,也可以由欧拉定律计算键数(即棱边数):60+(12+20)-2 = 90,C60分子所含单键数为:C60分子中单键为:90-30=60。(答“2×30(双键数)=60”即给2分) (4) 设C70分子中五边形数为x,六边形为y。依题意可得方程组:
=90,也可以由欧拉定律计算键数(即棱边数):60+(12+20)-2 = 90,C60分子所含单键数为:C60分子中单键为:90-30=60。(答“2×30(双键数)=60”即给2分) (4) 设C70分子中五边形数为x,六边形为y。依题意可得方程组:
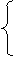
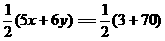 (键数,即棱边数)
(键数,即棱边数)
70+(x+y)- (欧拉定理)
(欧拉定理)
C分子中所含五边形数为解得:五边形数x=12,六边形数为六边形数y=25。
非本题原解:由C60分子知,该分子由60个碳原子构成,即C60分子结构中顶点数为60;又知每个碳原子与相邻三个碳原子形成价键,按有机化学相关知识,每个碳原子必须满足4个价键的规律,因此在每个碳原子形成的三个价键中,必须有一个为双键,有两个为单键,这样对C60分子来说,相当于单键数为双健数的两倍。
(1) 计算价键数(即棱边数)
由于每个碳原子连接三个价键(即棱边),对于C60分子来说,价键数(即棱边数)本应该为60×3=180个。但由于每一价键又被紧邻的两个五边形或六边形所共用,相当于有一半的价键(邻边)被重复计算。这样C60分子实际的价键数为60×3×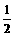 =90个。又由于90个价键中有
=90个。又由于90个价键中有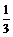 的价键为双键,
的价键为双键,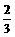 为单健,故分子中双键数为30个,单健数为60个。
为单健,故分子中双键数为30个,单健数为60个。
(2) 计算五边形及六边形的个数
根据欧拉定律,可列出顶点数、面数与棱边数三者的关系。再找出所有五边形及六边形的边数而列出方程。
设五边形有x个,六边形有y个,那么分子的总面数为x+y个,可得:
 60+(x+y)-2=60×3×
60+(x+y)-2=60×3×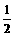 =90
=90
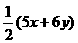 =60×3×
=60×3×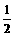 =90
=90
解得x=12,y=20。
16.1996年诺贝尔化学奖授予对发现C60有重大贡献的三位科学家。C60分子是形如球状的多面体(如图),该结构的建立基于以下考虑:
(1) C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;(97MCE)
(2) C60分子只含有五边形;
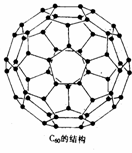
(3) 多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:

顶点数+面数-棱边数 = 2
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30。
请回答下列问题:
(1) 固体C60与金刚石相比较,熔点较高者应是_________,理由是:_____________________________________________
________________________________。
(2) 试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”)
___________,并简述其理由:__________________________________________。
(3) 通过计算,确定C60分子所含单键数。
(4) C70分子也制得,它的分子结构模型可以与C60同样考虑而推知。通过计算确定C70分子中五边形和六边形的数目。
33. (1) 1 cm3中阴、阳离子总数=( )3
)3
1 cm3中Ni2+-O2-离子对数=( )3×
)3×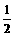
密度= =
=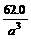 g·cm-3
g·cm-3
(说明:列式不化简不扣分;式中6.02×1023 mol-1用NA代入,即:
密度=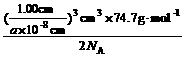 同样给分)
同样给分)
(2) 设1 mol中含Ni3+x mol,Ni2+ (0.97-x)mol
根据电中性:3x mol+2(0.97-x)mol=2×1 mol
x=0.06
Ni2+ 为(0.97-x)mol=0.91 mol
离子数之比Ni3+∶Ni2+=0.06∶0.91=6∶91
另解:(1) 因为在NiO晶体中,任意一个“离子”平均占有空间:( a×10-8)3cm3=a×10-24 cm3。
而一个“离子”平均具有的质量为: =6.20×10-23
g
=6.20×10-23
g
所以,一个“离子”的密度(即晶体之密度)为: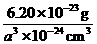 =
=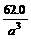 g·cm-3
g·cm-3
(2) 比例法
因为Ni3+与Ni2+分别与O2-形成Ni2O3和NiO,所以每当有一个Ni3+存在时,就有x个Ni2+同时存在。
则由题意可得镍离子与氧离子数之比为: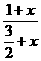 =
=
解之,得x=15.2。
所以,晶体中Ni3+与Ni2+的离子数之比为:1∶15.2=6∶91。
15. (1) 中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7 g·mol-1)(99MCE)

(2) 天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如右图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被Ni3+两个所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。
14.氮化硅(Si3N4)是一种新型的耐高温耐磨材料,在工业上有广泛用途,它属于( A )
A.原子晶体 B.分子晶体 C.金属晶体 D.离子晶体(01广东河南)
13.在金刚石的网状结构中, 含有由共价键形成的碳原子环, 其中最小的环上有______(填数字)个碳原子,每个碳原子上的任意两个C─C键的夹角都是________(填角度)。
6 109°28'或109.5° (MCE92.32)
12.氢化钠(NaH)是一种白色的离子晶体,其中钠是+1价。NaH与水反应放出氢气。下列叙述中,正确的是(MCE91.22) ( BC )
A. NaH在水中显酸性
B. NaH中氢离子的电子层排布与氦原子相同
C. NaH中氢离子半径比锂离子半径大
D. NaH中氢离子可被还原成氢气
11.碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是 ( A )
A. ①③② B. ②③① C. ③①② D. ②①③(MCE91.2)
10.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 (93.4) ( B )
A. SO2和SiO2 B. CO2和H2O C. NaCl和HCl D. CCl4和KCl
9.a、b、c、d、e、f、g为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下: (98上海)
|
粒子代码 |
a |
b |
c |
d |
e |
f |
g |
|
原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
带电荷数(单位电荷) |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子。
试写出:(1)a粒子的核外电子排布式
(2) b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为 > (用化学式表示)
(3) d溶于水的电离方程式
(4) g粒子所构成的晶体类型属
(5) c粒子是 ,f粒子是 (用化学式表示)
(1)1s22S22p6 (2)NaOH>Mg(OH)2 `(3) NH3+H2O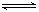 NH3·H2O
NH3·H2O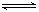 NH
NH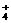 +OH- (4)分子晶体
+OH- (4)分子晶体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com