
题目列表(包括答案和解析)
23.(8分)从NaCl晶体中可以抽取出不同形状的晶体小碎片,这些晶体小碎片可以称为NaCl离子团簇。离子晶体或离子团簇表面存在悬挂键(即表面的离子有一种没有抓住相邻原子的化学键)。右图是立方体形状的NaCl离子团簇,其中大球代表Cl-,小球表代Na+。请回答下列问题:
① 与等质量的NaCl离子晶体相比,NaCl离子团簇具有 (填“较多”或“较少”)的悬挂键:
② NaCl离子团簇的熔点比NaCl大块晶体的熔点要 (填“高”、“低”或“-样”);
③ 如果团簇中离子对数相同,则团簇的总能量与团簇的外形是否有关 。
④ 食盐晶体由钠离子和氯离子组成,这两种离子在空间的三个垂直方向都是等距离地交错排列。已知食盐的密度是2.2g/cm3,则食盐中相邻的钠离子核间的数值最接近于( )
A.3.0×10-8cm B.3.5×10-8cm C.4.0×10-8cm D.5.0×10-8cm
22.(8分)1971年,斯图杰尔和阿佩里曼成功地合成了次氟酸。他们是在0℃以下将氟从细冰末上通过,得到毫克量的次氟酸。已知次氟酸的分子组成与次氯酸相似,分子中原子间也以共价键结合。
⑴写出次氟酸的结构式 ;
⑵写出上述制取次氟酸的化学方程式 ;
⑶次氟酸很不稳定,试预测其受热分解的可能途径,用化学方程式表示:
;
⑷次氟酸在刹那间能完成与热水的反应,此时得到的溶液,既表现有氧化性(对于Iˉ),又表现有还原性(对于MnO4ˉ),可推测次氟酸与热水反应的产物中含有 。
21.(10分)A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如下图所示转化关系(这些转化关系都不需要使用催化剂)。回答下列问题:
(1)若甲在转化中为还原剂,是常见金属,乙是常见非金属固态单质,且甲、乙、丙都由短周期元素组成,则A的结构式是___ __;B的电子式是__ ___,
(2)若甲在转化中为氧化剂,是常见非金属气态单质,丙是常见金属,甲、乙、丙中,只有甲由短周期元素组成。乙与甲同主族、与丙同周期,乙也有强氧化性,且反应都在溶液中、通常条件下进行,则:
①A与乙反应的离子方程式为:_____ ;
②C与丙反应的离子方程式为:_____ ____;
③当A与甲的物质的量之比为2:3时,A与甲恰好完全反应,且符合上图所示转化关系,则反应的离子方程式为:____ _____。
20.(16分) 化学工业在江苏国民经济中占有极其重要的地位,我省是国内最早的硫酸生产基地之一。工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔。在沸腾炉内二硫化亚铁与氧气发生反应,生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与氧气化合,生成三氧化硫; 三氧化硫流经吸收塔时,采用98.3%的浓硫酸吸收,使三氧化硫最终与水化合形成硫酸。
下面的装置是仿照工业上制备硫酸的流程设计出来的。见下图:
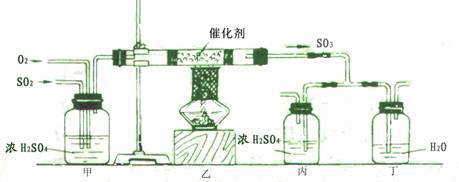
(1)写出二硫化亚铁与氧气反应的方程式: ;
(2)请写出上图甲装置的作用 ① ② ③ ;
(3)写出在催化剂表面所发生的反应的方程式: ;
(4)在乙反应器内要求氧气的量要比二氧化硫的量多一倍左右,你是如何控制与估计的?
;
(5)学生为了比较探究工业上为何采用98.3%的浓硫酸吸收三氧化硫而不用水,特用上述装置进行模拟实验。若丁装置在反应过程中先出现气泡,不久就出现了白雾,而丙装置一直都没有任何现象,产生这种现象的原因是:
;
(6)处理尾气的方法有: 。
19.(10分) 实验室用氯化钙固体和其他有关试剂(因为硝酸银价格昂贵不能使用),制取一定量纯净的硝酸钙固体
① 写出表示制取过程中反应原理的化学方程式
② 简述实验操作步骤(不要求回答使用的仪器,但要求回答试剂的用量:少量、适量或过量)
A. ;
B. ;
C. ;
D. 。
18.化工厂厂址的选择是一个复杂的问题,涉及原料、水源、能源土地供应、市场需求、交通运输和环境保护等诸多因素。硫酸厂应建在:
①靠近原料产地、远离消费中心;②靠近消费中心、稍偏离原料产地;③交通便利,人口稠密的居民区;④环保要求高的地区,便于“三废”治理;⑤风景秀丽、水资源充足的旅游胜地。
A.①②③④⑤ B.只有③④ C.只有② D.①②⑤
第Ⅰ卷 (选择题 共72分)答 案
第Ⅱ卷(非选择题 共78分)
17.某主族元素的离子X2+有6个电子层,最外层有2个电子,当把XO2溶于浓盐酸时,有黄色气体产生,则下列说法不正确的是
A.X2+具有还原性 B.X的+2价化合物比+4价化合物稳定
C.XO2具有强氧化性 D.该元素是第ⅡA族元素
16.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温下NO2和N2O4的混合气体,分子总数为NA
B.1mol羟基(-OH)中所含电子数为10NA
C.在用SiO2制取Si的反应中,每生成1molSi,转移电子数是4NA
D.在含1molH2O的冰中,存在的氢键的数目为2mol
15.不用其它试剂(可以加热),就能将下列溶液一一鉴别开来的是
A.NaOH、NaHCO3、NaHSO4、AlCl3 B.Ba(CH3COO)2、NaNO3、Ba(OH)2、H2SO4
C.NaOH、NH4NO3、HCl、KNO3 D.Na2SO4、Ca(NO3)2、BaCl2、Na2CO3
14.某混合气体可能含有CO、CO2、NH3、HCl、H2和水蒸气中的一种或几种,当依次通过澄清石灰水(无浑浊现象)、氢氧化钡溶液(有浑浊现象)、浓硫酸、灼热的氧化铜(变红)和无水CuSO4(变蓝),则可断定该混合气一定有
A.HCl、CO、H2O B.CO、H2、H2O
C.CO、H2、NH3 D. HCl、CO2、H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com