
题目列表(包括答案和解析)
31.(7分)向50mLNa2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得到14.51g白色沉淀,向白色沉淀中加入过量的稀HNO3,充分反应后,沉淀减少到4.66g,并有气体产生。
⑴原混合溶液中Na2SO4和Na2CO3的物质的量浓度各是多少?
⑵产生的气体在标准状况下的体积是多少?
30.(4分)⑴向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:______________________________________________________。
⑵在以上中性溶液中继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:
______________________________________________________。
29. (6分)将下列离子方程式改写成化学方程式:
⑴CO32-+2H+==CO2↑+H2O ________________________________________________。
⑵Cu2++2OH-==Cu(OH)2↓ _________________________________________________。
⑶Zn+2Ag+==Zn2++2Ag __________________________________________________。
28. (3分)根据反应:KClO3+6HCl==KCl+3Cl2↑+3H2O,若有0.5mol电子转移,则⑴有______molCl2生成。⑵有___________个HCl被氧化。⑶有__________个+5价Cl被还原。
27. (6分)配制0.1mol/L盐酸溶液500mL,请按操作顺序[⑴、⑵、⑶……]填写在操作前的括号内,并在横线上填写适当的仪器名称,操作方法或数字。
( )在盛盐酸的烧杯中注入蒸馏水(溶液体积少于500mL),用玻璃棒搅拌,使其均匀混合。
( )待稀释的盐酸冷却后,沿玻璃棒注入500mL的容量瓶中。
( )用量筒量取密度为1.19g/cm3质量分数为37%的浓盐酸约(取整数) mL注入烧杯中。
( )用蒸馏水洗涤烧杯2-3次,将洗涤液注入容量瓶中。
( )往容量瓶中小心加蒸馏水至液面接近刻度________cm处,改用________加蒸馏水,使溶液__________恰好与刻度线相切。
26. (6分)按要求写出有关氧化还原反应的化学方程式。
⑴是化合反应,也是氧化还原反应____________________________________________。
⑵是分解反应,也是氧化还原反应_____________________________________________。
⑶不属于四种基本反应类型的氧化还原反应____________________________________。
25. (3分)某同学从一种未知的无色溶液中检验出Ba2+、Ag+,同时溶液的酸性很强,他准备继续检验溶液中是否含有Cu2+、Cl-、CO32-、S2-、K+、Al3+、SO42-、SO32-、NO3-、Br-等离子。显然,有些离子还必须检验,你认为还必须检验的离子是__________________。
24.(12分)除去括号中杂质,写出所加试剂与反应的离子方程式。
⑴SO42-(CO32-),所加试剂:_________,离子方程式:___________________________。
⑵Cl-(SO42-),所加试剂:_________,离子方程式:___________________________。
⑶Fe2+(Cu2+),所加试剂:_________,离子方程式:___________________________。
⑷Cl-(CO32-),所加试剂:_________,离子方程式:___________________________。
23.体积为V、密度为ρ的某溶液中,含有摩尔质量为M的溶质的质量是m。若此溶液中溶质的物质的量浓度为c,溶质的质量分数为w,则下列各表示式中不正确的是 ( )
A. 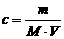 B.
B.
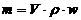 C.
C.  D.
D. 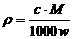
22.对溶液中的离子反应,下列说法:①不可能是氧化还原反应,②只能是复分解反应,③可能是置换反应,④不能没有单质参加,其中正确的是 ( )
A. ①③ B. ③ C.①② D. ③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com