
题目列表(包括答案和解析)
26.(12分)取0.1 mol某烷烃A完全燃烧,将生成物依次通过浓H2SO4和碱石灰,浓H2SO4、碱石灰分别增重5.4g、8.8g。B为烃的含氧衍生物,分子中的碳原子数不多于A,而相对分子质量比A多16n(n为正整数)。
⑴据此推断:A的分子式是 。B可能是 、
、 (填写你熟悉的物质结构简式)。
⑵若A的同系物A’与B的某一种物质混合,在150℃、1.01×105Pa条件下,取1 L该混合气体与9 L O2混合充分燃烧,恢复至原状况测得燃烧后气体体积比燃烧前增加了4%,则时生成1 L CO2,由此推断A’与B各是什么物质?原1 L 气体中A’与B的物质的量之比是多少?
25.氢氧化镁难溶于水,但它所溶解的那一部分则在溶液中完全电离。某温度时,饱和氢氧化镁溶液(溶液的密度为1.0g/cm3)中的c(Mg2+)=5×10-4mol / L ,若不考虑水的离子积KW值的变化,请填写下列空白:
⑴该溶液中OH-离子的物质的量浓度为 。
⑵该溶液中的溶质的质量分数为 。
⑶该温度下氢氧化镁的溶解度是 。

|

⑴请写出A、B、C的结构简式:A B C
⑵化合物B的系统命名为: 。
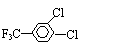
⑶含有三氟甲基和苯环的 的所有同分异构体数目为 。
24.(10分)宇航员佩戴头盔壳由聚碳酸酯制成,具有隔音、隔热、防碰撞、减震性好、质量小等特点。已知:苯酚分子中与酚羟基直接相连的碳原子的邻、对位上的氢原子有很好的反应
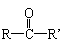
活性,易跟某些含羰基的化合物 (R、R’代表烷基或H原子)发生缩合反应生成
 新的有机物和水。苯酚还能发生如下反应生成有机酸酯:
新的有机物和水。苯酚还能发生如下反应生成有机酸酯:
下图是合成聚碳酸酯的过程(反应条件和部分产物未写出)
试回答问题:
⑴上述合成聚碳酸酯的化学反应中,属于加成反应的是 ,属于消去反应的是 。
⑵X的结构简式 ,X和浓溴水反应时,1 mol X最多能消耗Br2 mol。
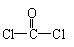
⑶在一定条件下X与 反应合成聚碳酸酯的化学方程式:
。
22.(8分)已知温度为TK、压强为pkPa时,往容积可变的密闭容器中充入2 molX和1 mol Y,此时容积为VL。若保持恒温恒压,经5min,反应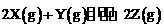 达到平衡,此时Z的体积分数为0.4。试回答下列问题:
达到平衡,此时Z的体积分数为0.4。试回答下列问题:
⑴达到平衡时,Y的物质的量为 mol。
⑵保持温度和压强在上述条件下恒定不变,再向上述密闭容器内充入4 mol Z,则反应达到平衡,容器的容积为 ,Z的体积分数为 。
⑶若另选一容积固定不变的密闭容器,仍控制温度为TK,使4 mol X和2 mol Y反应,达到平衡状态时,Z的体积分数仍为0.4,则该密闭容器的容积为 L。
21.(12分)已知X、Y、H、G、J均为三种由短周期元素构成的粒子,其结构特点如下:
|
粒子代码 |
X |
Y |
H |
G |
J |
|
原子核数 |
单核 |
双核 |
双核 |
三核 |
双核 |
|
电子数 |
10 |
10 |
18 |
10 |
15 |
|
粒子的电荷数 |
1个单位正电荷 |
1个单位负电荷 |
0 |
0 |
0 |
物质A由X、Y构成,B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示:
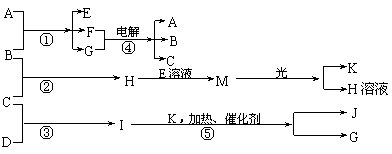
请填写下列空白:
⑴A的电子式为 ,从晶体结构的角度看,固态G的密度比液态G小的原因是
。
⑵反应①~⑤都可用于工业生产,其中反应⑤是工业制取 的基础,反应④的阳极反应式为 。工业上,向B的水溶液中加入CaCO3粉末可制取M,简要描述其化学原理 。
⑶标准状况下,若11.2L C气体在B气体中燃烧生成H气体时放出92.3kJ热量,则H气体完全分解的热化学方程式为 。
20.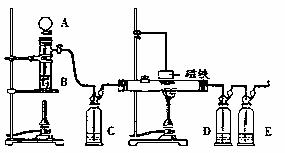 (12分)下图是用浓H2SO4和HCOOH制备CO还原Fe2O3并检验反应产物的实验装置图。
(12分)下图是用浓H2SO4和HCOOH制备CO还原Fe2O3并检验反应产物的实验装置图。
⑴A、B、C、E中应分别盛放
、 、 、
⑵制备CO的方程式为 ;
⑶加热还原Fe2O3之前首先要做 检验;然后还要做 试验,检验 是否被赶净;
⑷磁铁要在反应 (填“前”或“后”)才能吊在玻璃管上方,它的作用是
。
⑸D中所放物质为CuCl-NH3溶液,它的作用是 。
19.(8分)⑴某学生在实验报告中写出以下的实验操作或实验数据,你认为其中合理的是
(填代号)
A.用托盘天平称取29.25g的食盐
B.将浓硫酸沿容器器壁缓缓地倒入酒精中,并不断搅拌
C.用氯化亚铁晶体配制FeCl2溶液时还需加入稀盐酸和铁粉
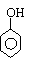 D.用湿润的pH试纸测得某溶液的pH为10
D.用湿润的pH试纸测得某溶液的pH为10
E.在比较H2O、CH3COOH、CH3CH2OH、 等分子中-OH上氢原子活性的时候,加入的物质和顺序是⑴NaHCO3,⑵NaOH,⑶Na。
F.将生香蕉和熟香蕉捆在同一个塑料袋中,生香蕉很快变熟了,这主要因为“温室”效应造成的
⑵某甲酸溶液中,可能混有甲醛,如何通过化学实验来证明其中是否有甲醛。写出简要的操作步骤:
。
18.从矿物学家资料查得:当胆矾溶液渗入地下遇硫铁矿(FeS2)时,可以生成辉铜矿(Cu2S),同时,还生成FeSO4和H2SO4化学方程式如如下:
14CuSO4十5FeS2十12H2O=7Cu2S十5FeSO4十12H2SO4
对上述事实的下列分析,正确的是
A.FeS2既是氧化剂又是还原剂
B.Cu2S既是氧化产物又是还原产物
C.在上述反应中,每生成1 mol Cu2S时,共得到2 mol电子
D.在上述反应中,每5 mol FeS2反应生成5 mol FeSO4时,共失去21 mol电子
第II卷 (非选择题 共78分)
17.有两只串联的电解池(惰性电极),甲池盛有CuSO4溶液,乙池盛有一定量某硝酸盐的稀 溶液。电解时当甲池电极析出1.6gCu时,乙池电极析出0.54g金属,则乙池的溶质可能是
A.AgNO3 B.Cu(NO3)2 C.Mg(NO3)2 D.Al(NO3)3
16.现有两种不含结晶水的盐,它们在不同温度下的溶解度分别是:
20℃ 50℃
A的溶解度 35.7g 46.4g
B的溶解度 31.6g 108g
下列说法中,正确的是
A.可采用重结晶法使A、B混合物分离
B.若把108g B的饱和溶液从50℃降到20℃,析出的B是76.4g
C.在20℃时,A、B都可以配成溶质质量分数为25%的不饱和溶液
D.两种盐在某一温度下具有相同的溶解度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com