
题目列表(包括答案和解析)
6.三氯化磷分子的空间构型是三角锥形而不是平面正三角形。下列关于三氯化磷分子空间构型理由的叙述,正确的是( )。
A.PCl3分子中三个共价键的键长、键角均相等
B.PCl3分子中的P-Cl键属于极性共价键
C.PCl3分子中三个共价键的键长、键角均相等,且属于极性分子
D.PCl3分子中的P-Cl键的三个键角都是100.1º,键长相等
5.下列各种变化中,不属于化学变化的是( )。
A.向鸡蛋白溶液中滴入饱和硫酸铵溶液,析出白色沉淀
B.加热胆矾得到白色的无水硫酸铜粉末
C.向沸水中滴入饱和氯化铁溶液,制取氢氧化铁胶体
D.向鸡蛋白溶液中滴入硝酸铅溶液,析出白色沉淀
4.元素周期表中第七周期为不完全周期,若将来的发现把第七周期全排满,则下列推论可能错误的是( )
A.第七周期元素都是放射性元素
B.该周期原子序数最大的元素单质一定不与任何物质反应
C.该周期0族元素的原子序数为118
D.该周期ⅢA族元素的氢氧化物性质与Al(OH)3不同
3.NA代表阿伏加德罗常数,以下说法正确的是( )
A.121gCCl2F2所含的氯原子数为2NA
B.常温常压下1mol NO2气体与水反应生成NA个NO3-离子
C.氯化氢气体的摩尔质量等于NA个氯气分子和NA个氢分子的质量之和
D.124gNa2O溶于水后所得溶液中含有O2-离子数为2NA
2.下列四组物质间的反应,其中与其他三个有本质不同的是( )
A.Cl2+H2O→ B.NO2+H2O→ C.F2+H2O→ D.Na2O2+H2O→
1.“纯净水”、“太空水”、“蒸馏水”等商品作为日常饮料水,因缺少某些成分而不利于少年儿童身体健康,你认为在制备上述商品饮料水时至少还需要添加微量的化学物质是( )。
A.钙和镁的碳酸氢盐 B.含碘酸盐的食盐
C.漂白粉等消毒剂 D.小苏打
18.(9分)钇(Y)元素可用于制造激光发生器和超导材料,我国蕴藏丰富的含钇矿石(YxFeBe2Si2O10),矿石中铁为+2价。现将4.68 g钇矿石样品与氢氧化钠共熔,反应后加适量水溶解过滤,滤渣中有Y(OH)3和Fe2O3,滤液中有Na2SiO3和Na2BeO2等,此反应中钇元素的化合价未变化。将滤液配成1 L溶液,测其pH=13,往此溶液中加入100 mL 3.3 mol/L的盐酸后,溶液pH=1,其中有BeCl2等物质。(假设反应前后溶液体积无变化)
(1)根据反应中铍元素的变化,分析Be(OH)2属于何种性质的氢氧化物。
(2)推算x的值。
(3)计算钇元素的相对原子质量。
17.(6分)已知高温下能发生如下反应:Si+C===SiC。现有石英砂和碳粉的混合物a mol,在高温电炉中隔绝空气充分反应,反应完全后,冷却得到残留固体。
(1)写出可能发生反应的化学方程式。
(2)若石英砂与混合物的物质的量之比为x(0<x<1),试讨论x的取值范围,残留固体的成分和物质的量,并将结果填入下表中:
|
x值 |
残留固体分子式(或化学式) |
物质的量/mol |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
说明:①残留固体物质的量用a,x等表示,不必列出具体的计算式。
②每组空格填一种情况,有几种填几种,不必填满。
16.(10分)Cl2和NO2在室温下可以化合生成一种新的气态化合物C,为了测定C的分子组成,进行以下实验。取混合气体总体积5 L,测定反应后总体积随Cl2在混合气体中所占体积分数(x)的变化规律。实验测知当Cl2所占体积分数为20%或60%时,反应后的总体积均为4 L。
(1)通过分析和计算求得化合物C的化学式为 ,发生反应的化学方程式为 。
(2)试讨论当x的取值范围不同时,反应后总体积(V)随x变化的函数关系。
15.(6分)(2002年全国高考试题)如图所示:
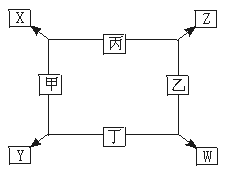
已知:
①甲、乙、丙、丁均为前三周期元素的单质。
②在一定条件下甲与丙和甲与丁都按物质的量之比1∶3反应,分别生成X和Y,在产物中元素甲呈负价。
③在一定条件下乙与丙和乙与丁都按物质的量之比1∶2反应,分别生成Z和W,在产物中元素乙呈负价。
请填空:
(1)甲是 ,乙是 。
(2)甲与丙反应生成X的化学方程式是 。
(3)乙与丁反应生成W的化学方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com