
题目列表(包括答案和解析)
26.(14分)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱,但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
⑴单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表示)。⑵写出锌和氢氧化钠溶液反应的化学方程式 。
⑶下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
⑷写出可溶性铝盐与氨水反应的离子方程式 。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因 。
13.一定条件下,向一带活塞的密闭容器中充入2mol SO2 和1mol O2
,发生下列反应: 2SO2(g)+O2 2SO3(g)达到平衡后改变下述条件,SO3 气体平衡浓度不改变的是( )
2SO3(g)达到平衡后改变下述条件,SO3 气体平衡浓度不改变的是( )
A.保持温度和容器体积不变,充入1molSO2(g)
B.保持温度和容器压强不变,充入1molSO3(g)
C.保持温度和容器压强不变,充入1molO2(g)
D.保持温度和容器压强不变,充入1molAr(g)
12.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
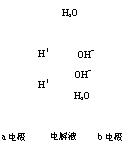
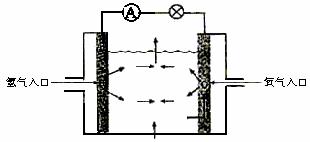
A.a电极是负极
B.b电极的电极反应为:4OH―-4e―=2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
11.在一定温度下,某无水盐R在水中溶解度为23g,向R的饱和溶液中加入Bg该无水盐,保持温度不变,析出R的结晶水合物Wg,从原饱和溶液中析出溶质R的质量为( )
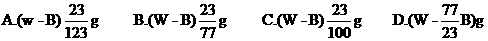
10.下列混合溶液中,各离子浓度的大小顺序正确的是( )
A.10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合:c(Cl-)>c(NH4+)>c(OH―)>c(H+)
B.10mL01mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合:c(Na+)=c(Cl-)>c(OH―)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合:
c(Na+)=c(CH3COO-)>c(OH―)>c(H+)
D.10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合: c(Cl-)>c(Na+)>c(OH―)>c(H+)
9.仅用一种试剂鉴别如下物质:CCl4、NaI溶液、NaCl溶液、Na2SO3 溶液,下列试剂中不能选用的是 ( )
A.溴水 B.FeCl3 溶液 C.酸性KMnO4 溶液 D.AgNO3 溶液
8.核磁共振(NMR)技术级广泛应用于复杂分子结构的测定和医学论断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象( )
A.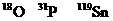 B.
B. 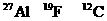
C.元素周期表中VA族所有元素的原子 D.元素周期表中第1周期所有元素的原子
7.NA 代表阿伏加德罗常数值,下列说法正确的是( )
A.9g重水所含有的电子数为5 NA
B.1molMgCl2 中含有离子数为NA
C.7.1g氯气与足量NaOH溶液反应转移的电子数为0.2 NA
D.1 mol C10H22 分子中共价键总数为31 NA
28.(12分)A为烃,B为烃的含氧衍生物。由等物质的量的A和B组成的混和物0.05mol在0.125mol的氧气中完全燃烧,生成0.1mol的CO2和0.1molH2O。试通过计算回答:
(1)从分子式角度看,该混和物组成有几种可能,写出各组成的分子式:
(2)另取一定量的A和B完全燃烧,将其以任意物质的量比混和,且物质的量之和一定:
①若耗氧量一定,则A、B的分子式分别是
②若生成的CO2、H2O的物质的量一定,则A、B分子式分别是 。
(3)另取a mol的任意比混合的A和B的混合物,在过量的氧气中完全燃烧
①若耗氧量为定值,则该值为 mol(用含a的代数式表示)
②若生成物CO2的量为定值,则生成物水的质量范围为 。
27.(8分)有一种矿物,化学式为MgxBay(CO3)z,现用下述方法对它进行分析,据所得结果,求该矿物的化学式。
用过量盐酸溶解一分矿样,所得溶液用水稀释至100mL,在这过程中放出44.8mLCO2(标准状况)。取25.0mL所得溶液,需要用25.0mL浓度为0.02mol/L的EDTA(一种配位剂的简称)滴定才达到终点。用过量的稀硫酸去处理另一份25.0mL的溶液,得到0.058g的硫酸钡沉淀。(计算时可以假设第ⅡA族金属离子跟EDTA反应生成1:1的生成物。)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com