
题目列表(包括答案和解析)
8.下列溶液在常温下能跟镁反应生成氢气的是
(A)NaCl (B)NH4Cl (C)NaOH (D)Na2CO3
9.质量为8.02克的铁片,放进1.0升浓度为0.90摩/升的CuSO4溶液中,过一段时间取出冲净、干燥后称重,变为8.66克.若认为溶液的体积没有变化,则Cu2+的浓度变为
7.氢化钠(NaH)是一种白色的离子晶体,其中钠是+1价.NaH与水反应放出氢气.下列叙述中,正确的是
(A)NaH在水中显酸性
(B)NaH中氢离子的电子层排布与氦原子的相同
(C)NaH中氢离子半径比锂离子半径大
(D)NaH中氢离子可被还原成氢气
6.为了除去MgCl2酸性溶性中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后再加入适量盐酸.这种试剂是
(A)NH3·H2O (B)NaOH (C)Na2CO3 (D)MgCO3
5.用含硫量较高的生铁来炼钢时,应采取的措施是
(A)使用较多的生石灰 (B)加入较多的焦炭
(C)加入较多的硅铁 (D)掺入含磷较高的废钢
4.下列物质中,可用作冶炼镁的原料的是
(A)冰晶石 (B)光卤石 (C)萤石 (D)高岭石
3.分别加热下列三种物质各100克:①KMnO4、②KClO3(另加少量MnO2、③HgO.完全反应后,所放出的氧气量由多到少的顺序是
(A)①>②>③ (B)②>①>③
(C)①>③>② (D)②>③>①
1.下列四种物质,只能跟NaOH溶液作用,不能跟盐酸作用的是
(A)NaHS (B)NaAlO2 (C)KHSO4 (D)CH3COONH4
2.把0.05摩NaOH固体分别加入下列100毫升液体中,溶液的导电能力变化不大的是:
(A)自来水 (B)0.5摩/升盐酸
(C)0.5摩/升醋酸 (D)0.5摩/升氯化铵溶液
29. (14分)将32.64g铜与140mL 一定浓度的硝酸反应,铜完全溶解产生的NO和NO2 混合气体在标准状况下的体积为11.2L。请回答:
(14分)将32.64g铜与140mL 一定浓度的硝酸反应,铜完全溶解产生的NO和NO2 混合气体在标准状况下的体积为11.2L。请回答:
⑴NO的体积为 L,NO2 的体积为 L。
⑵待产生的气体全部释放后,向溶液中加入VmLamol/L的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,则原硝酸溶液的浓度为 mol/L
⑶欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水
28.(19分)I.合成氨工业对化学和国防工业具有重要意义。写出氨的两种重要用途 。II.实验室制备,下列方法中适宜选用的是 。
①固态氯化铵加热分解 ②固体氢氧化钠中添加浓氨水
③氯化铵溶液与氢氧化钠溶液共热 ④固态氯化铵与氢氧化钙混合加热
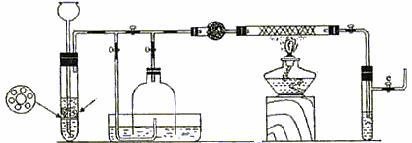
III.为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[实验操作]
①检查实验装置的气密性后,关闭弹簧夹a 、b、c、d、e,在A中加入锌粒,向长颈漏斗注入一定量稀硫酸,打开弹簧夹c、d、e,则A中有氢气发生,在F出口处收集氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
⑴检验氢气纯度的目的是 。
⑵C瓶内水位下降到液面保持不变时,A装置内发生的现象是 。防止了实验装置中压强过大,此时再打开弹簧夹b的原因是 ,C瓶内气体的成份是 。
⑶在步骤③中,先加热铁触媒的原因是 ,反应管E中发生反应的化学方程式是 。
27.(19分)烯烃通过臭氧氧化并经锌和水处理得到醛或酮。例如:


|
|

|
|
I.已知丙醛的燃烧热为1815kJ/mol,丙酮的燃烧热为1789kJ/mol,试写出丙醛燃烧的热化学方程式 。
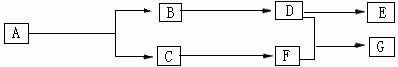
II.上述反应可用来推断烯烃的结构,一种链状单烯烃A通过臭氧化并经锌和水处理得到B和C,化合物B含碳69.8%,含氢11.6%,B无银镜反应,催化加氢生成D,D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E。反应图示如下:
|
|
|
|
|
|
|
|
回答下列问题:
⑴B的相对分子质量是 ;D→F的反应类型为 。D含有官能团的名称 。
⑵D+F→G的化学方程式是 。
⑶A的结构简式为 。
⑷化合物A的某种同分异构体通过臭氧氧化并经锌和水处理只得到一种产物,符合该条件的异构体的结构简式有 种。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com