
题目列表(包括答案和解析)
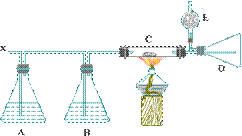
1、如下图所示的装置中,当浓HCl和重铬酸钾共热产生有色气态单质X,X经A、B两瓶后在C处与热的白色晶体反应,最后在D瓶中生成紫黑色的晶状物。回答下列问题:
(1)制取X气体时,需要用到的玻璃仪器有 _____。
(2)若K2Cr2O7被还原成Cr3+,写出制取X的化学方程式 _____。
(3)要得到纯净的X气体,A瓶中盛放_____,B瓶中盛放_____。
(4)C处的白色晶体是_____,D瓶的紫黑色晶体是_____,C处加热的目的是_____。
(5)E装置盛石灰的作用是_____。
1、(1)E接D,C接A,B接F,G接J(或K)
(2)x+16/a=18/(c
-b)
(3)①C ②A
(4)加热CuO之前应先通H2,将反应管中空气排净后再加热CuO停止实验时应先熄灭酒精灯,继续通H2至反应管冷却至室温,再停止通H2。
2、(1)a接g2,g1接e2,e1接c2,c1接d1,d2接h2
(2)防止无水CaCl2吸收空气中水蒸气,增大测定误差。
(3)⑦、③、①、②、⑤、⑥、④、⑦
(4)n -(w
-m)/(w -m)
(5)无影响
3、(1)F接G,H接D,C接B,A接E。
(2)2NaCl+H2SO4 2HCl+Na2SO4
4HCl+MnO2
2HCl+Na2SO4
4HCl+MnO2 MnCl2+Cl2↑+H2O
(3)吸收多余Cl2防止污染空气,Cl2+2OH-
MnCl2+Cl2↑+H2O
(3)吸收多余Cl2防止污染空气,Cl2+2OH-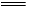 Cl-+ClO-+H2O
(4)溶液变蓝色 Cl2+2I-
Cl-+ClO-+H2O
(4)溶液变蓝色 Cl2+2I-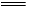 I2+2Cl-
(5)当Cl2过量时,会将I2氧化成更高价的碘化物从而使溶液褪色。
4、(1)15.6
(2)Cu
(3)黑色热铜网接触乙醇后变亮红色,产生有刺激性气味的液体。
(4)①Na2O2+2CO2
I2+2Cl-
(5)当Cl2过量时,会将I2氧化成更高价的碘化物从而使溶液褪色。
4、(1)15.6
(2)Cu
(3)黑色热铜网接触乙醇后变亮红色,产生有刺激性气味的液体。
(4)①Na2O2+2CO2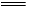 2Na2CO3+O2
③2C2H5OH+O2
2Na2CO3+O2
③2C2H5OH+O2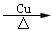 2CH3CHO+2H2O
④CH3CHO+2Cu(OH)2
2CH3CHO+2H2O
④CH3CHO+2Cu(OH)2 CH3COOH+Cu2O↓+2H2O
5、(1)D;
(2)生成的少量Cl2及水蒸汽被碱石灰吸收,D管中将生成部分钴的氯化物;
(3)AD;
(4)装置B内的液体倒流,致使试管破裂;
(5)2∶3。
6、(1)不应把烧碱直接放在天平托盘上,不应把称量物放在右盘、砝码放左盘,这样称得的质量不足5.2g。
(2)把氢氧化钠溶液从烧杯转移入容量瓶时,没有用蒸馏水洗净烧杯和玻璃棒,把洗涤液一并转移入容量瓶里 偏低不应直接倒入用水洗净的度剂瓶 偏低
(3)不应用氢氧化钠溶液冲洗锥形瓶,移液管洗净后应用待测的氢氧化钠溶液润洗2-3次
(4)23.50, 0.20, 23.30
(5)0.1×23.3/20×40/4.8×100%=97.1%
7、(1)、③、④、⑤、⑦、⑧
(2)锥形瓶 由无色变粉红色,半分钟内不褪色
(3)稀释后 H2SO4=0.14×(16.5-1)/(20.00×2)=0.05425mol/L
稀释前 H2SO4=0.05425×100=5.425mol/L
(4)偏高 (5)偏高 (6)偏低
8、(1)C→A→B→D→E
(2)滴定管要直立;装液或放液后,需等1-2分钟后才能观察液面高度;读数时,防止俯视或仰视,视线应在凹面底与液面相切处,读数时应准确读在0.1mL;
(3)垫一张白张是为了使滴定终点颜色变化更为明显,易为分辨;
(4)液面应调节到零刻度或以下,尖嘴部分应充满液体
(5)偏高,因碱液样品沾在锥形瓶内壁使锥形瓶里的烧碱的物质的量增加,需耗用标准硫酸溶液的体积增大,故使测出的烧碱浓度偏高
(6)0.8(V2-V1)M/w ×100%
9、在醋酸溶液中滴入石蕊试液变红,加入醋酸铵固体,振荡溶液,颜色明显变浅。[H+]变小是由于加入CH3COO-使平衡向左移动,由此说明醋酸溶液中存在着醋酸的电离平衡。
10、各取等体积的碱液,同时用蒸馏水稀释相同倍数(如100倍),然后用pH试纸检验,pH值较小(变化较大)的是强碱。
CH3COOH+Cu2O↓+2H2O
5、(1)D;
(2)生成的少量Cl2及水蒸汽被碱石灰吸收,D管中将生成部分钴的氯化物;
(3)AD;
(4)装置B内的液体倒流,致使试管破裂;
(5)2∶3。
6、(1)不应把烧碱直接放在天平托盘上,不应把称量物放在右盘、砝码放左盘,这样称得的质量不足5.2g。
(2)把氢氧化钠溶液从烧杯转移入容量瓶时,没有用蒸馏水洗净烧杯和玻璃棒,把洗涤液一并转移入容量瓶里 偏低不应直接倒入用水洗净的度剂瓶 偏低
(3)不应用氢氧化钠溶液冲洗锥形瓶,移液管洗净后应用待测的氢氧化钠溶液润洗2-3次
(4)23.50, 0.20, 23.30
(5)0.1×23.3/20×40/4.8×100%=97.1%
7、(1)、③、④、⑤、⑦、⑧
(2)锥形瓶 由无色变粉红色,半分钟内不褪色
(3)稀释后 H2SO4=0.14×(16.5-1)/(20.00×2)=0.05425mol/L
稀释前 H2SO4=0.05425×100=5.425mol/L
(4)偏高 (5)偏高 (6)偏低
8、(1)C→A→B→D→E
(2)滴定管要直立;装液或放液后,需等1-2分钟后才能观察液面高度;读数时,防止俯视或仰视,视线应在凹面底与液面相切处,读数时应准确读在0.1mL;
(3)垫一张白张是为了使滴定终点颜色变化更为明显,易为分辨;
(4)液面应调节到零刻度或以下,尖嘴部分应充满液体
(5)偏高,因碱液样品沾在锥形瓶内壁使锥形瓶里的烧碱的物质的量增加,需耗用标准硫酸溶液的体积增大,故使测出的烧碱浓度偏高
(6)0.8(V2-V1)M/w ×100%
9、在醋酸溶液中滴入石蕊试液变红,加入醋酸铵固体,振荡溶液,颜色明显变浅。[H+]变小是由于加入CH3COO-使平衡向左移动,由此说明醋酸溶液中存在着醋酸的电离平衡。
10、各取等体积的碱液,同时用蒸馏水稀释相同倍数(如100倍),然后用pH试纸检验,pH值较小(变化较大)的是强碱。
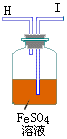
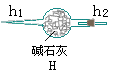
1、利用H2还原CuO的实验可以测定铜的相对原子质量。从氢气发生器中导出来的气体中含有少量H2S、HCl、H2O,还原CuO之前必须除去。还原氧化铜时产生的水可用无水CaCl2吸收。进行此测定实验可以从下图中选取必要的仪器:
|
序
号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
|
仪
器 |
 |
 |
 |
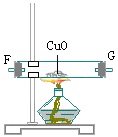 |
 |
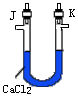 |
请回答:
(1)实验时气流方向从左向右,上述必要仪器的导管连接的顺序为_____。
(2)实验前后测定的有关数据如下:实验前氧化铜质量为ag,无水CaCl2和U型管的总质量为bg;实验后测得装置⑥的总质量为cg,如果实验过程中H2为足量,且反应进行得很完全,则计算Ca相对原子质量x的数学式为_____。
(3)下列实验操作对x值有什么影响?从下列选项中选取适当答案回答:
A、无影响 B、偏大
C、偏小 D、不能肯定
①用未经干燥的H2还原CuO_____;
②实验结束时,先停止通H2,后熄灭酒精灯_____。
(4)用H2还原CuO时,加热氧化铜和停止加热的正确操作方法是_____。
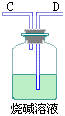
2、用下图所示仪器装置制取H2,再用H2还原CuO,最后根据CuO质量的减少和无水CaCl2质量的增加来测定水的质量组成。

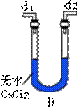
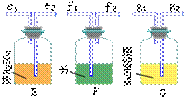
 请回答:
(1)如果制得H2从左向右流向时,上述仪器的连接顺序是a接_______,_____接_____,_____接_____,_____接_____(碱石灰)。
(2)实验装置里最后连接盛放碱石灰干燥管的目的是_____。
(3)装入药品后进行实验,有下列的步骤:正确操作的步骤是_____①打开
A的活塞;②点燃C处酒精灯;③检查装置的气密性;④关闭活塞,停止产生H2;⑤等CuO变红后撤去酒精灯;⑥通入H2,使C中的物质冷却;⑦称量C管和D管的质量。
(4)若测得的原质量为wg的硬质玻璃管C,反应后质量变为mg;U型管实验后质量增加ng,则水中氢、氧两元素的质量比可表示为_____。
(5)若实验中有部分CuO被还原为红色的Cu2O,对实验的影响为_____(偏大、偏小、无影响)。
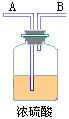
3、为了比较卤元素单质氧化性强弱,可在实验室先制取Cl2,并将Cl2分别通入溴化钠溶液和碘化钾淀粉溶液中。 下图是所用仪器及药品:
请回答:
(1)如果制得H2从左向右流向时,上述仪器的连接顺序是a接_______,_____接_____,_____接_____,_____接_____(碱石灰)。
(2)实验装置里最后连接盛放碱石灰干燥管的目的是_____。
(3)装入药品后进行实验,有下列的步骤:正确操作的步骤是_____①打开
A的活塞;②点燃C处酒精灯;③检查装置的气密性;④关闭活塞,停止产生H2;⑤等CuO变红后撤去酒精灯;⑥通入H2,使C中的物质冷却;⑦称量C管和D管的质量。
(4)若测得的原质量为wg的硬质玻璃管C,反应后质量变为mg;U型管实验后质量增加ng,则水中氢、氧两元素的质量比可表示为_____。
(5)若实验中有部分CuO被还原为红色的Cu2O,对实验的影响为_____(偏大、偏小、无影响)。
3、为了比较卤元素单质氧化性强弱,可在实验室先制取Cl2,并将Cl2分别通入溴化钠溶液和碘化钾淀粉溶液中。 下图是所用仪器及药品:
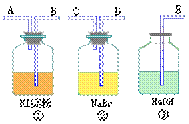

 试回答:
(1)若所制气体从左向右流向时,上述各仪器接口的连接顺序为_____接_____,_____接_____,_____接_____,_____接_____。
(2)实验开始后装置⑤中反应的化学方程式为_____
(3)装置③的作用是_____,其中反应的离子方程式为_____
(4)装置①中发生的现象是_____;反应的离子方程式为_____。
(5)若通入过量Cl2①中颜色会消失,试分析其原因:_____
4、根据下面的转化关系和实验现象填写下列空白:
试回答:
(1)若所制气体从左向右流向时,上述各仪器接口的连接顺序为_____接_____,_____接_____,_____接_____,_____接_____。
(2)实验开始后装置⑤中反应的化学方程式为_____
(3)装置③的作用是_____,其中反应的离子方程式为_____
(4)装置①中发生的现象是_____;反应的离子方程式为_____。
(5)若通入过量Cl2①中颜色会消失,试分析其原因:_____
4、根据下面的转化关系和实验现象填写下列空白:
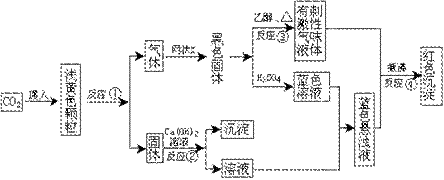 (1)反应①中,当生成气体在标准状况下体积为2.24L时,所消耗的淡黄色颗粒质量为_____g。
(2)网状X的化学式是_____。
(3)反应③的现象是_____。
(4)写出有关的化学方程式: 反应①_____,反应②_____,反应③_____。
5、1820年,德贝尔钠首次使用MnO2作催化剂加热分解KClO3,制备O2,当时就发现气态产物有异常气味,后来证明是因为其中含少量Cl2的O3(臭氧)等杂质。已知O3的氧化性比O2强,且与还原剂反应时通常生成O2。碳酸钴(CoCO3)在加热条件下与氧气的反应可表示为:
(1)反应①中,当生成气体在标准状况下体积为2.24L时,所消耗的淡黄色颗粒质量为_____g。
(2)网状X的化学式是_____。
(3)反应③的现象是_____。
(4)写出有关的化学方程式: 反应①_____,反应②_____,反应③_____。
5、1820年,德贝尔钠首次使用MnO2作催化剂加热分解KClO3,制备O2,当时就发现气态产物有异常气味,后来证明是因为其中含少量Cl2的O3(臭氧)等杂质。已知O3的氧化性比O2强,且与还原剂反应时通常生成O2。碳酸钴(CoCO3)在加热条件下与氧气的反应可表示为:
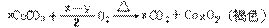 现利用如下实验装置测定固体CoxOy的组成。
现利用如下实验装置测定固体CoxOy的组成。
 请填写下列空白。
(1)E装置中U形管内填充的试剂是_____。(填选项的标号)
A、五氧化二磷 B、无水氯化镁
C、无水硫酸铜 D、碱石灰
(2)若实验装置中,接口a与b直接相连,而不用B、C装置,会导致测定结
果产生偏差,其原因是_____。
(3)B洗瓶内所盛的物质可以是_____。(填选项的标号)。
A、NaOH溶液 B、饱和NaHCO3溶液
C、淀粉溶液 D、KI溶液
(4)实验结束时,若先撤去A装置的酒精灯,会引起_____。
(5)碳酸钴完全转化为褐色的CoxOy后,称得E管增重4.4克,D管内残留物的质量是8.3克,据此可以推知褐色物质(CoxOy)中x∶y=_____。
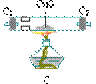
6、为了测定烧碱中NaOH的百分含量,根据实验数据填空白。
(1)欲称量5.2g烧碱,调整托盘天平的零点后,左盘上放一枚5g的砝码,将游码拨到0.2g处,然后往天平右盘上缓缓倒烧碱颗粒,当天平达到平衡时,停止加烧碱。
在称量过程中,有两处错误:①_____,②_____。
(2)配溶液,把称得的烧碱放入烧杯里,加适量的蒸馏水,用玻璃棒搅拌,完全溶解后,转入1000mL的容量瓶里,然后往容量瓶加蒸馏水,振荡容量瓶里的溶液使混合均匀,然后缓缓地把蒸馏水注入容量瓶直至液面接近刻度2-3cm处。改用胶头滴管加入到瓶颈刻度的地方,使溶液的凹面正好跟刻度相平。把容量瓶塞好,反复摇匀后,倒入预先用水洗净的试剂瓶里备用。配溶液的过程中有两处错误:①_____,②_____,这错误使测定的NaOH含量_____。
(3)滴定准备 用水洗净锥形瓶,再用待测的氢氧化钠溶液冲洗2-3次,然后将20mL移液管用蒸馏水洗净后吸取氢氧化钠溶液20mL移到锥形瓶里,移液管尖端靠在锥形瓶内壁溶液自由流下。这操作过程中也有两处错误:
①_____,②_____。
请填写下列空白。
(1)E装置中U形管内填充的试剂是_____。(填选项的标号)
A、五氧化二磷 B、无水氯化镁
C、无水硫酸铜 D、碱石灰
(2)若实验装置中,接口a与b直接相连,而不用B、C装置,会导致测定结
果产生偏差,其原因是_____。
(3)B洗瓶内所盛的物质可以是_____。(填选项的标号)。
A、NaOH溶液 B、饱和NaHCO3溶液
C、淀粉溶液 D、KI溶液
(4)实验结束时,若先撤去A装置的酒精灯,会引起_____。
(5)碳酸钴完全转化为褐色的CoxOy后,称得E管增重4.4克,D管内残留物的质量是8.3克,据此可以推知褐色物质(CoxOy)中x∶y=_____。
6、为了测定烧碱中NaOH的百分含量,根据实验数据填空白。
(1)欲称量5.2g烧碱,调整托盘天平的零点后,左盘上放一枚5g的砝码,将游码拨到0.2g处,然后往天平右盘上缓缓倒烧碱颗粒,当天平达到平衡时,停止加烧碱。
在称量过程中,有两处错误:①_____,②_____。
(2)配溶液,把称得的烧碱放入烧杯里,加适量的蒸馏水,用玻璃棒搅拌,完全溶解后,转入1000mL的容量瓶里,然后往容量瓶加蒸馏水,振荡容量瓶里的溶液使混合均匀,然后缓缓地把蒸馏水注入容量瓶直至液面接近刻度2-3cm处。改用胶头滴管加入到瓶颈刻度的地方,使溶液的凹面正好跟刻度相平。把容量瓶塞好,反复摇匀后,倒入预先用水洗净的试剂瓶里备用。配溶液的过程中有两处错误:①_____,②_____,这错误使测定的NaOH含量_____。
(3)滴定准备 用水洗净锥形瓶,再用待测的氢氧化钠溶液冲洗2-3次,然后将20mL移液管用蒸馏水洗净后吸取氢氧化钠溶液20mL移到锥形瓶里,移液管尖端靠在锥形瓶内壁溶液自由流下。这操作过程中也有两处错误:
①_____,②_____。
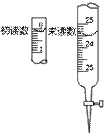 (4)滴定 于锥形瓶里滴入无色酚酞
溶液3-5滴,然后用装有0.01mol/L的盐酸
标准溶液滴定,盐酸的初读数和终读数如
右图所示:
盐酸终读数_______mL;初读数_______
mL;用量_____mL。
(4)滴定 于锥形瓶里滴入无色酚酞
溶液3-5滴,然后用装有0.01mol/L的盐酸
标准溶液滴定,盐酸的初读数和终读数如
右图所示:
盐酸终读数_______mL;初读数_______
mL;用量_____mL。
 (5)按称得烧碱的实际质量和滴定所得数据计算烧碱含NaOH的质量分数
(可不考虑操作中的误差)。 NaOH的质量分数=_____。
7、用0.14mol/LNaOH溶液测定某浓度的H2SO4溶液,其实验步骤如下:
(1)配制稀H2SO4溶液,取10.00mL待测H2SO4溶液,配制成1.00L稀H2SO4溶液。在配制过程中,应选用下列仪器中的(用序号填空)_____。①烧瓶 ② 锥形瓶 ③容量量瓶 ④烧杯 ⑤酸式滴定管 ⑥漏斗 ⑦玻璃棒 ⑧胶头滴管 ⑨量筒
(2)滴定 用酸式滴定管取稀释后硫酸溶液20mL,注入____中,再滴入几滴酚酞试液,摇匀后,用0.14mol/LNaOH溶液进行滴定,直至加入最后一滴NaOH溶液时,恰好使溶液_____即可停止滴定。
(5)按称得烧碱的实际质量和滴定所得数据计算烧碱含NaOH的质量分数
(可不考虑操作中的误差)。 NaOH的质量分数=_____。
7、用0.14mol/LNaOH溶液测定某浓度的H2SO4溶液,其实验步骤如下:
(1)配制稀H2SO4溶液,取10.00mL待测H2SO4溶液,配制成1.00L稀H2SO4溶液。在配制过程中,应选用下列仪器中的(用序号填空)_____。①烧瓶 ② 锥形瓶 ③容量量瓶 ④烧杯 ⑤酸式滴定管 ⑥漏斗 ⑦玻璃棒 ⑧胶头滴管 ⑨量筒
(2)滴定 用酸式滴定管取稀释后硫酸溶液20mL,注入____中,再滴入几滴酚酞试液,摇匀后,用0.14mol/LNaOH溶液进行滴定,直至加入最后一滴NaOH溶液时,恰好使溶液_____即可停止滴定。
(3)计算 根据右图所示0.14mol/LNaOH溶液的 用量,计算稀释后H2SO4溶液的物质的量浓度_____。 (4)碱式滴定管在注入NaOH溶液之前,用水洗 净后,立即转入0.14mol/L的NaOH溶液,其结果将会
使测得的H2SO4溶液的物质的量浓度_____(偏高、偏低、无影响)。
(5)滴定前,盛稀释后H2SO4溶液的容器用水洗净后,用稀硫酸润洗,再准确量取20.00mL稀释后的H2S溶液,并滴入数滴酚酞试液,然后用NaOH溶液滴定。结果会使测得的H2SO4溶液物质的量浓度_____(偏高、偏低、无影响)。
(6)滴定前,碱式滴定管内无气泡,在滴定结束时,管内进了气泡,记录消耗NaOH溶液体积时未赶走气泡,结果将会使H2SO4溶液的浓度_____(偏高、偏低、无影响)。
8、某烧碱样品含有少量不与酸作用的杂质,为了滴定其纯度,进行以下操作。
A、在250mL的容量瓶中定量配成250mL烧碱溶液;
B、用移液管称取25mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙;
C、在天平上准确称取烧碱样品wg,在烧杯中用蒸馏水溶解;
D、将物质的量浓度为M的标准硫酸溶液装入酸式滴定管,调节液面开始读数为V1;
E、在锥形瓶下垫一张白纸,滴定至橙色为止,记下读数V2。试填空。
(1)正确操作步骤的顺序是(用字母)_____→_____→_____→D→_____→_____
(2)观察滴定管里液面的高度时应注意_____。
(3)E步骤的操作中,锥形瓶下垫一张白纸的作用是_____。
(4)D步骤的操作中液面应调节到_____,尖嘴部分应_____。
(5)某学生实验时把锥形瓶用烧碱样品洗涤,使测得的浓度偏高还是偏低?原因是_____。
(6)该烧碱样品纯度的计算式是_____。
9、试用简单实验证明在醋酸溶液中存在着: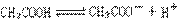 的电离平衡。(要求写出简要操作,现象及实验能说明的问题)。
10、有两瓶pH=12的碱溶液,一瓶是强碱,一瓶是弱碱。现有石蕊试纸,酚酞试液,pH试纸和蒸馏水而无其它试剂。简述如何用最简便的实验方法判断哪瓶是强碱_____。
的电离平衡。(要求写出简要操作,现象及实验能说明的问题)。
10、有两瓶pH=12的碱溶液,一瓶是强碱,一瓶是弱碱。现有石蕊试纸,酚酞试液,pH试纸和蒸馏水而无其它试剂。简述如何用最简便的实验方法判断哪瓶是强碱_____。
附答案:
实验题的形式繁多,它常把实验的基本操作,实验原理,实验现象、实验设计,元素化合物的性质,化学计算和推理融为一体进行考查。它具有知道面广,命题新颖,思考容量大,综合性强等特点。它不但能用来考查考生的观察能力,操作能力,分析能力和实验设计能力,还用来考查考生创造性思维能力和数据处理的能力。不仅要求考生知其然,还要知其所以然。因此实验题的解答要求高,难度较大。只有考生对实验题的功能,考查范围,考查特点弄清弄懂,才能理顺解答实验题的思路。
67.取a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g。下列物质中不能满足上述结果的是
(A). H2 (B). CO (C).C6H12O6 (D). C12H22O11
66.下列离子中,所带电荷数与该离子的核外电子层数相等的是
(A).Al3+ (B).Mg2+ (C).Be2+ (D).H+
65.等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为
(A).3:4:1 (B).3:3:2 (C).6:7:3 (D).6:9:0
64. 将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是
(A).稀硝酸 (B).稀盐酸 (C).硝酸铜 (D).氢氧化钠
63.在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是
(A).Mg (B). Cu (C). Ag (D). H2
62.强热硫酸亚铁固体可发生如下反应2FeSO4 Fe2O3
+SO2↓+SO3↑若将此反应生成的气体通入BaCl2溶液中,则
(A).析出BaSO3沉淀 (B).析出BaSO4沉淀
(C).逸出SO3气体 (D).逸出SO2气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com