
题目列表(包括答案和解析)
11、在没有现成的CO2气体发生器的情况下,请你选用下图所示部分仪器装配成一个简易的、能随开随用、随关随停的CO2气体发生装置。
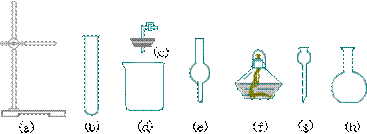
(1)应选用的仪器是(填入编号)_____。
(2)若用上面已装配好的实验装置制取CO2气体,而实验室只有稀H2SO4、浓HNO3、水、块状大理石。比较合理的方案,你认为应选的药品是_____。
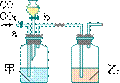 12、某学生用下图所示装置进行一氧化碳和二氧化碳混合气体的分离和干燥,其中a为铁夹,b为分液漏斗的活塞。
12、某学生用下图所示装置进行一氧化碳和二氧化碳混合气体的分离和干燥,其中a为铁夹,b为分液漏斗的活塞。
(1)甲瓶内盛_____溶液;乙瓶内盛_____溶液;
分液漏斗内盛_____溶液。
(2)实验先分离出一氧化碳,方法是先关闭____,
再打开_____。
(3)分离完一氧化碳后,再收集二氧化碳。方法是先关闭_____,再打开_____。
10、下面是某学生设计的制取二氧化碳并且使其在高温下与碳反应,证明有一氧化碳生成的有关实验装置图。
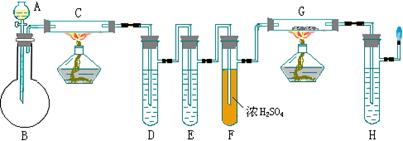
① A、B、C、D中应装药品名称_____。
② 装置D、E所起作用_____。
③ 写出D、E、G中化学反应方程式_____。
④ 你对上述实验证明有没有改进意见?如果有,说明理由。
9、实验室用干燥的氨气在加热条件下与氧化铜反应,来制取较纯净的铜粉和氮气(允许含少量的水蒸气),实验是由下图的六个装置组合而成。
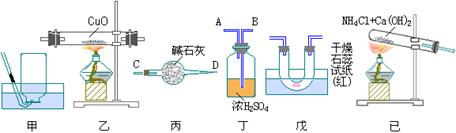
(1)如果氨气的流向是从左到右,则甲-己各装置和连接顺序应是(填各图的序号,如甲、乙、丙)_____,其中丙、丁两装置与其它装置相连接时,气体应从_____口流入丙装置,从_____口流入丁装置。
(2)反应进行一段时间后,可观察到戊中的现象为_____,这证明前面反应过程中有_____生成。
(3)写出乙装置中反应的化学方程式:_____
(4)装置丙的作用是_____;装置丁的作用是_____。
(5)当观察到_____现象时,说明实验可以结束。
8、已知NH3和CuO反应可得较纯净的铜、氮气和水。现在利用氨的还原性来测定氨分子中各元素的质量分数,同时测定氨氧化的百分含量(在反应中生成的气体用排水法测出其体积(假设水的体积为标况下气体的体积)。
(1)用下图装置连接成整套实验装置(填入各接口代号与字母):
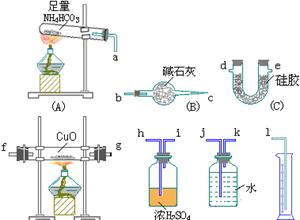
a接()()接()()接()()接()()接()()接()
a接____,____接____,____接____,____接____,____接____,____ 接____。
(2)整套装置安装完毕后,检验气密性的方法是_____。
(3)仪器连接好进行实验时,先点燃_____处的酒精灯,实验结束时应撤出____处的酒精灯,其理由是_____。
(4)装置B的作用是_____,装置C的作用是_____,装置E的作用是_____。
(5)写出D装置中发生反应的化学方程式_____。
(6)测得D装置中试剂质量减少了mg,C装置中质量增加了ng,E装置中质量增加了xg,G装置中水的体积为y升。则NH3中氮原子与氢原子数之比为(用m,n,y表示)_____。被氧化的NH3的质量分数为(用x,y表示)_____。
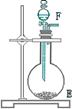
7、用浓氨水跟新生石灰作用,可以生成氨气;干燥的氨气在高温下跟氧化铜反应,可被氧化成氮气。实验室欲用下图所示仪器装置和药品来制取纯净的氮气:
|
序号 |
① |
② |
③ |
④ |
|
仪 器 装 置 |
 |
 |
 |
 |
请回答下列问题:
(1)这些装置按气流方向自左至右的连接顺序是下接_____、_____接_____、 _____接_____、_____。
(2)E中发生反应的化学方程式是_____。
(3)装置④中应选用的干燥剂是_____。
(4)装置①中发生的氧化还原反应的化学方程式是_____。
(5)装置②中浓H2SO4的作用是_____。
6、环境监测测定水中溶解氧的方法是:
(1)量取amL水样迅速加入固定剂MnSO4溶液(含KOH),立即塞好塞子,并振荡摇匀,使之充分反应。
(2)测定: 开塞后迅速加入适量硫酸(提供H+)使之生成I2,再用bmol/L的Na2SO2O3溶液滴定(和I2反应),消耗了3VmL(以淀粉为指示剂)。有关的化学方程式为:
① 2Mn2++O2+4OH-==2MnO(OH)2(该反应极快)
② MnO(OH)2+2I-+4H+==Mn2++I2+3H2O
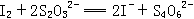
试回答:
(1)水中溶解氧的量(以g/L为单位)的计算式为_____。
(2)滴定时(I2和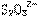 反应以淀粉为指示剂,终点时溶液由_____色变为________色。
反应以淀粉为指示剂,终点时溶液由_____色变为________色。
(3)测定时,滴定管经水洗之后,加滴定剂Na2S2O3会导致测定结果_____(填偏高、偏低或无影响)。
(4)滴定前滴定管充满Na2S2O3,并已排除气泡,但由于操作不慎,滴定后观察刻度时,发现滴定管下端有气泡,会导致测定结果_______(填偏高、偏低无影响)
(5)若打开塞子加H2SO4时动作缓慢,测定结果将_____(填偏高、偏低或无影响)。
5、连二硫酸钠(Na2S2O4)溶液可用于吸收氧气,反应生成亚硫酸氢钠。该性质可以用于定量地测定氧气的含量。在氯酸钾和二氧化锰混合加热制取氧时,常含有少量Cl2和酸酐Cl2O产生,为测定KClO3分解后生成的O2的量,称取2.50gKClO3和0.50g MnO2作实验,所用药品、仪器和导管请从下图中选取(能用几种仪器就选几种仪器,不必全选):
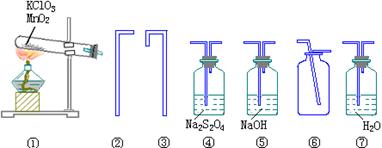
请填写下列空白
(1)实验中所选用的仪器装置的连接顺序是(填各装置的序号,连接胶管省 略)_____。
(2)写出实验室中Cl2、Cl2O分别与NaOH溶液发生反应的化学方程式_____、_____。
(3)如果生成的O2完全被吸收、称量出现的④的增重为0.9g,则KClO3中分解生成O2的部分,占全部KClO3的_____%。
4、过二硫酸钾(K2S2O8)在高于100℃的条件下发生下列反应:
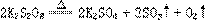
现称取一定的K2S2O8 固体(含有不分解的杂质),进行如下实验;加热使过二硫酸钾完全分解,通过测定氧气的体积计算过二硫酸钾的纯度,并且收集三氧化硫,进行观察和检验。
(1)试从下图中选用几种必要的装置,连接成一整套实验装置。这些选用装置的接口编号连接顺序是_____。
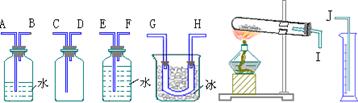
(2)观察到的三氧化硫的颜色和状态是_____。将三氧化硫与水反应,鉴定反应产物中阴离子的方法是_____。
(3)若实验时称取过二硫酸钾的质量为w克,测得氧气的体积(折算成标准状况)为a毫升,则此过二硫酸钾的纯度为_____。
3、下图是实验室测定黄铁矿中硫的质量分数的装置。实验时有如下操作:
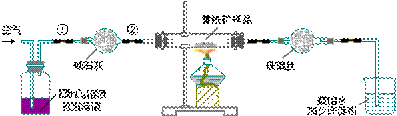
A、将瓷管中黄铁矿样品加热到800℃-850℃;
B、称取研细的黄铁矿样品;
C、连接全部仪器,使其成为整套实验装置,并检查装置的气密性。
D、将样品小心地放入瓷管中部;
E、以每分钟1L的速度鼓入空气;
F、用标准碘液滴定含淀粉的SO2水溶液。
(1)正确的实验步骤,其操作编号是_____。
(2)装置①的作用是_____,装置②的作用是_____。
(3)应根据_____现象判断滴定已达到的终点而停止鼓入空气。
(4)碘液跟SO2水溶液发生反应的化学方程式是_____。
(5)假定矿石样品的硫全部转化为二氧化硫,并全部被水吸收。若称得矿样的质量是0.12g,滴定中共消耗浓度为0.05mol/L的标准碘液25.50mL,则黄铁矿样品中的含硫量是_____。
2、以六水合氯化镁(MgCl2·6H2O)为原料制备无水氯化镁。
已知:MgCl2·6H2O晶体在空气中加热时,释出部分结晶水,同时生成Mg(OH)Cl或MgO;在干燥HCl气流中加热能制得无水MgCl2。可选用药品:MgCl2·6H2O晶体、NaCl(固)、KClO3(固)、MnO2、浓H2SO4、浓HCl、稀NaOH溶液。
仪器:见下图(装置可重复使用)。回答下列问题:
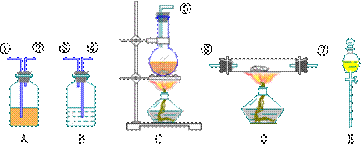
(1)组装氯化氢气体发生器,选用的仪器(用编号A、B、…填入)是_____;有关的化学方程式:_____。
(2)接HCl气流方向,其余装置的连接顺序(用数字1、2填入)是:()→()()→()()→()()
(3)各装置中应放的药品为:A_____;B_____;C_____;D_____;E_____。
(4)B装置的作用是_____,B中能观察到的现象是_____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com