
题目列表(包括答案和解析)
2、(1)CE,NaCl+H2SO4 NaHSO4+HCl↑
NaHSO4+HCl↑
(2)5、1、2、7、8、4、3
(3)浓H2SO4、稀NaOH溶液、NaCl、MgCl2·6H2O、浓H2SO4
(4)尾气吸收,防止污染大气 白雾
1、(1)分液漏斗、烧瓶、酒精灯、导管
(2)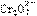 +14H++6Cl- == 2Cr3++3Cl2↑+7H2O
+14H++6Cl- == 2Cr3++3Cl2↑+7H2O
(3)饱和食盐水(或水),浓H2SO4
(4)碘化钾(或氢碘酸盐),碘,使生成的碘升华并分离出来
(5)防止Cl2污染空气。
20、下图是实验室制备CO并用CO还原Fe2O3的实验装置图:回答下列问题:
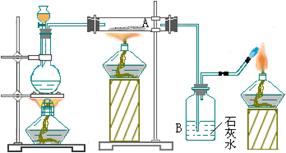
(1)写出HCOOH和浓H2SO4共热制备CO的化学方程式_____。
(2)根据实验事实填写下表
|
|
实验现象 |
有关化学方程式 |
|
A处(Fe2O3) |
|
|
|
B处(澄清石灰水) |
|
|
|
C处 |
|
|
(3)若烧瓶中放置草酸晶体(H2C2O4·2H2O)写出浓H2SO4和草酸晶体共热制备CO的化学方程式:________________________。
(4)怎样净化(3)制得CO?
附答案:
19、某课外活动小组拟用下图所示装置做炼铁原理的实验,同时检测氧化铁的纯度(假设矿石中不含有其它与CO反应的成分),并除去尾气。CO气体用草酸(固态物质,化学名称乙二酸,结构简式为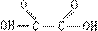 )为原来制取:
)为原来制取: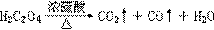 与Fe2O3反应的CO需纯净、干燥。回答:
与Fe2O3反应的CO需纯净、干燥。回答:

(1)装置中导管a1的作用是_____
(2)若所制气体从左向右流向,上述仪器组装,连接的顺序是(用a,b,…表示):___接___,___接___,___接___,___接___,___。
(3)现有一份FeO和Fe2O3的混合物,某同学想用上述装置测定其中Fe2O3的质量分数(P)。实验中可测得如下数据:w──反应前混合物的质量(g),△w丁──丁瓶增重的质量(g),△w丙──丙瓶增重的质量(g), w余── 反应后残余固体的质量(g)为测定P,至少需测定上述数据中的_____ 个,为几个有用的数据的组合共有_____种。请将这些组合填入空格中(每空填一种组合,有几种就填几种,不一定填满,也不必列算式。)
18、为测定一种含脉石的矿石的主要成分,进行以下实验:
(1)称取矿石粉末1.250g,加入过量的稀H2SO4溶液,直至反应完全,产生无色无味气体A 0,.420g,同时生成浅绿色物质B的溶液,并有不溶性残渣剩余。
(2)将A气体通入过量饱和石灰水中,析出0.955g白色沉淀。
(3)滤去不溶性残渣的B溶液,用适量蒸馏水稀释至100mL。取溶后的溶液少许,加过氧化氢,生成含C物质的黄色溶液,再加入KSCN溶液呈血红色。
(4)移取定后的B溶液25mL, 用0.020mol/L KMnO4酸性溶液滴定,当消耗21.55mL时刚好达到滴定终点。
根据以上实验数据回答:
(1)完成并配平B溶液与KMnO4反应的离子方程式:
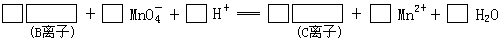
(2)气体A的分子量为_____,分子式为_____。
(3)矿石的主要成分为(写化学式)_____。
(4)矿石的主要成分在样品中的质量为_____g,其质量分数为_____%。
(5)根据上述推算,矿石除主要成分和脉石外,还可能含有_____杂质。
17、现要制备无水AlCl3并保存,再用所制得的AlCl3制备少量的Al2O3。(甲)能选用的仪器装置如下图所示。
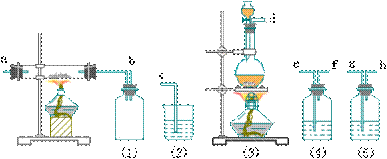
(乙)能选用的试剂如下: A、食盐晶体; B、水; C、饱和食盐水;
D、碱石灰; E、烧碱溶液; F、铝粉; G、二氧化锰; H、浓H2SO4; I、浓氨水; J、硅胶。
(丙)整个实验程序为:制Cl2─→净化和干燥Cl2─→制AlCl3─→冷却、贮存─→制Al2O3。根据以上题给条件,试回答:(1)从上述仪器中选取若干连成一个制备无水AlCl3的装置。用装置图中各管口(连接点)的标号按先后顺序可连接为:()接()、()接(),()接(),()接()。
(2)填空连接装置中各选用仪器里盛放的物质:
|
选用仪器标号 |
|
|
|
|
|
|
放入的试剂标号 |
|
|
|
|
|
(3)用制备的AlCl2制Al2O3,所用的试剂除AlCl3和水外,还应选用_____,在这一过程中要借助的基本化学实验操作名称有_____。
16、KMnO4可将12mol/L盐酸氧化成氯气。现将0.05g KMnO4固体和两段2cm长的镁条放入22×220试管中,加入1.5ml 12mol/L盐酸后立即盖上软木塞。并用一燃着的镁条在试管附近进行照射,如下图所示。

请回答下列问题:
(1)点燃镁条以后试管内最主要的现象是_____。
(2)写出试管内全部反应的化学方程式:
15、工业生产的碱中常含有少量的NaCl等杂质,下图是测定产品有Na2CO3质量分数的实验装置,操作步骤是:
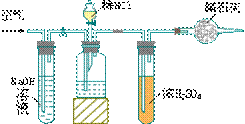
A、在干燥管内填满碱石灰,质量为mg
B、取ng样品装入广口瓶中
C、检验装置的气密性
D、缓缓鼓入空气数分钟,再称干燥管质量为wg
E、关闭止水夹
G、缓缓加入稀硫酸至不再产生气体为止
H、缓缓鼓入空气数分钟
(1)正确的操作顺序是(填写符号):
C─→_____─→F─→_____─→E─→_____─→G─→_____─→D。
(2)操作步骤D中,要缓缓鼓入空气数分钟,鼓入空气的作用是_____;装置A的作用是_____;装置B的作用是_____。
(3)Na2CO3质量分数的计算式为_____。
(4)若去掉装置A,测定结果_____;若去掉装置B,测定结果_____(填“偏大”、“偏小”或“无影响”)。
14、现有一定量含有Na2O杂质的Na2O2试样。请从下图中选用适当的实验装置,设计一个最简单的实验,测定Na2O2试样的纯度,(可供选用的反应物只有CaCO3固体6mol/L的盐酸和蒸馏水)。请完成下列空白:
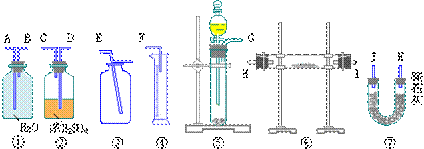
(1)写出在实验中Na2O2和Na2O分别发生的化学方程式_____、_____。
(2)应选用的装置是(只要求写出图4-23中装置的标号)_____。
(3)所选用的装置的连接顺序应是(填各接口的字母,连接胶管省略)____。
13、四氯化锡在常温下为无色液体(沸点为114℃,它极易溶于水。金属锡的熔点为231℃。利用下图所示仪器装置,设计组装一个实验,在干燥的系统中用熔融的金属与氯气直接作用制取无水四氯化锡。

(1)连接下述装置的正确顺序是(填各接口的代码字母):_____接_____, _____接_____,____接_____,_____接_____。
(2)装置(己)的作用是_____,(丁)的作用是_____。
(3)冷凝管里冷却水的流向是从_____进入,从_____流出。
(4)若四氯化锡遇水强烈水解的产物之一为二氧化锡,那么四氯化锡水解的化学方程式为_____。
(5)制取的四氯化锡少许置于空气中,可以看到的现象是_____。
(6)为了防止空气污染,在装置最后应_____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com