
题目列表(包括答案和解析)
29、当化学反应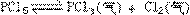 处于平衡状态时,向其中加入一种37Cl含量较高的氯气,平衡发生移动,在建立新平衡以前,PCl3所含37Cl的百分含量比原平衡状态时是否会增加?请说明理由_______________________。
30、对于可逆反应:
处于平衡状态时,向其中加入一种37Cl含量较高的氯气,平衡发生移动,在建立新平衡以前,PCl3所含37Cl的百分含量比原平衡状态时是否会增加?请说明理由_______________________。
30、对于可逆反应: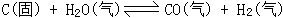 达到平衡后,增大压强(反应在密闭容器中进行),平衡混合气的平均相对分子质量_________(填A、增大,B、减小,C、不变,D、可能增大也可能减小或不变),其原因是____________________。如果设平衡时H2O(气)、CO(气)、H2(气)的物质的量分别为X、Y、Zmol,则要使平衡时混合气体的平均相对分子质量增大或不变,则X、Y、Z必须满足的关系式是__________。
31、工业上生产钾是用金属钠与熔化的KCl反应制取,反应式如下:
达到平衡后,增大压强(反应在密闭容器中进行),平衡混合气的平均相对分子质量_________(填A、增大,B、减小,C、不变,D、可能增大也可能减小或不变),其原因是____________________。如果设平衡时H2O(气)、CO(气)、H2(气)的物质的量分别为X、Y、Zmol,则要使平衡时混合气体的平均相对分子质量增大或不变,则X、Y、Z必须满足的关系式是__________。
31、工业上生产钾是用金属钠与熔化的KCl反应制取,反应式如下:
 (1)为什么选用850℃作为反应的适宜条件?其主要原因是_____________。
(2)工业制钾主要应用____________________原理,使可逆反应变为现实。
(1)为什么选用850℃作为反应的适宜条件?其主要原因是_____________。
(2)工业制钾主要应用____________________原理,使可逆反应变为现实。
28、把除去氧化膜的镁条投入到盛有 稀盐酸的试管中,发现氢气发生的速率 变化如右图所示,其中t1-t2速率变化
22、在碘化钾和硫酸的混合溶液中加过氧化氢水溶液,迅速反应放出大量气体,反应过程可表示如下:
①H2O2 + 2KI
+ H2SO4 == I2 + K2SO4 +
2H2O
②H2O2 + I2 == 2HIO
③H2O2 + 2HIO == I2 + O2↑ + 2H2O
(1)H2O2在反应③中的作用是_____(填标号)。
(A)氧化剂 (B)既是氧化剂又是还原剂
(C)还原剂 (D)既不是氧化剂也不是还原剂
(2)有人认为:上述反应说明了碘单质是过氧化氢分解的催化剂。你认为对吗?_______,其理由是_____________________________________。
(3)上述反应说明H2O2、I2、HIO氧化性从强到弱的顺序是_____。
23、在某条件下,容器中有如下平衡反应: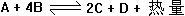 此时,A、B、C的物质的量均为amol,而D的物质的量为dmol。
(1)改变a的取值,再通过改变反应条件,可以使反应重新达到平衡。并限定达到新的平衡时,D的物质的量只允许在d/2到2d之间变化,则a取值范围应是__________(用a和d的关系式表示)。
(2)如果要使本反应重新建立在平衡中,D物质的量只允许在d到2d之间取值,则应采取的措施是__________________(从下面列出的选项中选择)。
(A)升高反应温度
(B)增大反应容器之压强
(C)增大反应容器容积
(D)降低反应温度
(E)减小反应容器内之压强
(F)减小反应容器容积
24、有两组关于物质熔点的数据
此时,A、B、C的物质的量均为amol,而D的物质的量为dmol。
(1)改变a的取值,再通过改变反应条件,可以使反应重新达到平衡。并限定达到新的平衡时,D的物质的量只允许在d/2到2d之间变化,则a取值范围应是__________(用a和d的关系式表示)。
(2)如果要使本反应重新建立在平衡中,D物质的量只允许在d到2d之间取值,则应采取的措施是__________________(从下面列出的选项中选择)。
(A)升高反应温度
(B)增大反应容器之压强
(C)增大反应容器容积
(D)降低反应温度
(E)减小反应容器内之压强
(F)减小反应容器容积
24、有两组关于物质熔点的数据
|
|
1组 |
2组 |
||||||
|
物质 |
NaCl |
KCl |
RbCl |
CsCl |
SiCl4 |
GeCl4 |
SnCl4 |
PbCl4 |
|
熔点 |
808℃ |
772℃ |
717℃ |
645℃ |
-70.4℃ |
-49.5℃ |
-36.2℃ |
-15℃ |
分析以上数据,回答: (1)有什么规律可循?__________________。 (2)造成这些规律的主要原因是:______________________。
|
m |
1 |
2 |
3 |
4 |
|
a |
0.25 |
0.45 |
0.56 |
0.62 |
|
x |
16.7% |
21.5% |
19.4% |
16.4% |
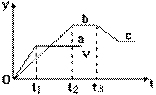 ①所得结论____________________。
②反应物的最佳配比是____________________,其原因是_____________________。
25、已知氯水中有如下平衡,
①所得结论____________________。
②反应物的最佳配比是____________________,其原因是_____________________。
25、已知氯水中有如下平衡,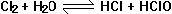 ,常温下,在一容积为
50mL的针铜中吸入40mL氯气后,再吸入10mL水,写出针筒中可能观察到的现象是_____________。若将此针筒长时间放置,又可看到何种变化____________,试用平衡观点加以解释:_____________________________。
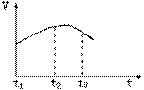
26、氯酸与亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如下图所示,又知这个反应速率随着溶液(H+)增大而加快。
,常温下,在一容积为
50mL的针铜中吸入40mL氯气后,再吸入10mL水,写出针筒中可能观察到的现象是_____________。若将此针筒长时间放置,又可看到何种变化____________,试用平衡观点加以解释:_____________________________。
26、氯酸与亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如下图所示,又知这个反应速率随着溶液(H+)增大而加快。
(1)写出该反应的化学方程式______________。 (2)反应开始时速率加快的原因是______________。 (3)反应后期反应速率慢的原因是______________。
 27、一般来讲,绝大多数化学反应都有一定的可逆性,试回答:硫在盛纯氧的集气瓶中燃烧后,可能有少量SO3生成,则在盛空气的集气瓶中转化的SO2将更低,原因是______________________________。
27、一般来讲,绝大多数化学反应都有一定的可逆性,试回答:硫在盛纯氧的集气瓶中燃烧后,可能有少量SO3生成,则在盛空气的集气瓶中转化的SO2将更低,原因是______________________________。
1、下列说法是否正确?为什么?
(1)物质是由分子构成的,分子是保持物质化学性质的一种微粒。
(2)由同种元素组成的物质一定是单质。
(3)酸性氧化物都是酸酐,它们和水反应生成相应的酸。
(4)碱性氧化物肯定是金属氧化物,金属氧化物肯定是碱性氧化物。
(5)酸性氧化物肯定是非金属氧化物,非金属氧化物肯定是酸性氧化物。
(6)同种元素可有不同种原子,它们的化学性质几乎完全相同。
(7)具有相同质子数的微粒都属于同种元素。
(8)具有相同分子组成的化合物都属于同种物质。
(9)有新单质生成的化学反应,肯定属于氧化还原反应。
(10)既能跟酸反应,又能跟碱反应的化合物都属于两性化合物。
2、化合物A是一种不稳定的物质,它的分子组成可用OxFy表示,10mLA气体能分解生成15mLO2和10mLF2(同温同压下测定)试回答:①A的化学式________,推断的理由是______________________________________。
②已知在A分子中,x个氧原子呈-O-O…链状排列,每一根短线代表一对共用电子,试写出A分子的电子式_______,A分子的结构式_______,并标出每一个原子的化合价_____。
3、根据你的理解,某种不溶于水的金属氧化物,如果要判别它是酸性氧化物、碱性氧化物,还是两性氧化物,其方法是_______________________。
4、4mLO2和3mLNxHy(y>x)混合气体在120℃,1.01×105Pa下点燃完全反应后,恢复到原温度和压强时,测得反应后N2、O2、H2O(气)混合气体密度减小3/10。
(1)反应的化学方程式为________________________。
(2)推算NxHy的化学式:
①计算的根据是(用文字叙述)__________________,即(用含有x、y的代数式表示)________________________。
②解方程得________________,当___________时合题意,所以NxHy的化学式为_______________________。
5、基于硫和硒的相似性及硫酸钾和硒酸钾晶型相同,1820年米希尔里希认为这两种盐组成相同。所以在已知硫原子相对原子质量(32)的前提下,根据下列数据求出硒的相对原子质量。硫酸钾中含:钾a%,硫b%,氧c%;硒酸钾中含:钾d%,硒e%,氧f%。
(1)判断硫或硒相对原子质量大的依据是_______________________。
(2)米希尔里希求硒的相对原子质量的计算式是_______________________。
6、溴蒸气密度几乎是氯气密度和碘蒸气密度的(数学)平均值(密度是在同温、同压下测定的)。由这个实验结果可知_____,能否用上述实验结果知道氯、溴、碘的化学式?
7、1892年拉姆塞和雷利发现了氩,他们从实验中发现氩是一种稀有气体,并测得相对原子质量为40.0。请你设计一个方案,证实它是单原子分子。
8、在天平的两个托盘上各放一个盛有等体积稀H2SO4的烧杯(每杯溶液中都含有mmol的H2SO4),调节天平使其平衡。然后在一个烧杯中加入ag铁粉,在另一个烧杯中加入bg镁粉,充分反应后,天平仍平衡。试用代数式表示在下列各种情况下,a与b的关系(关系式中可含m)。
(1)若a/56>m,b/24>m时,________________。
(2)若a/56<m,b/24<m时,_________________。
(3)若a/56<m,b/24>m时,_________________。
(4)若a/56>m,b/24<m时,天平能否平衡,说明理由__________________。
9、白色的亚铜化合物Cu(NH4)SO3难溶于水。若与足量的10mol/L的硫酸溶液混合并微热,生成铜和SO2气体及溶液。
(1)完成并配平化学方程式: (2)按上述操作,铜的最高转化率是_____。
(3)有人设计让上述反应在密闭容器中进行,结果铜的转化率大大提高。问在密闭容器中反应,铜的最高转化率是________,其理由________________。
10、已知:AgF + Cl2 + H2O
→ AgCl + AgClO3 + HF +
O2(未配平)。若Cl2系数为a,则AgF的系数为_______,判断的依据是________;若AgClO3的系数为b,O2系数为c,则AgCl的系数为________,判断的依据________________。
11、我国北方地区的某些小盐湖,冬天湖底有纯碱晶体析出,夏天偶尔可见有食盐晶体析出。简述其原因。
12、在饱和Na2CO3的溶液中通入足量的CO2会有晶体析出,此晶体是_______;析出此晶体的原因是因为_______________。在饱和食盐水中先通入足量的氨,再通入足量的CO2会有NaHCO3晶体析出;若在饱和食盐水中先通入足量CO2,再通入氨气往往没有晶体析出,原因是___________________________。
13、托盘天平的两盘分别放上盛MgCl2和Na2CO3晶体的表面皿,两者质量相等,然后用玻璃罩把整个托盘天平罩上。经过一段时间,托盘天平发生倾斜,这是因为_________________________________。
14、无水CaCl2可用作干燥剂。有人认为夏天用CaCl2水溶液代替自来水喷洒柏油马路会得到更好的效果。其原因是____________________________。
15、CaCl2和冰的混合物是实验室常用的致冷剂,可获得-55℃的低温。在配制冷冻剂时,采用CaCl2·6H2O好,还是采用无水CaCl2好?为什么?
16、向盛沸水的小烧杯中滴入FeCl3溶液,然后将此溶液倒入U形管里并加外电场,最后加MgCl2溶液于U形管里。
简述上面实验过程中发生的现象_________________________,
写出有关的化学方程式_______________________________。
17、实验时,手指不慎划破,可从急救箱中取出FeCl3溶液应急止血,其原理是_______________________________________。
18、1840年盖斯根据一系列实验事实得出规律,他指出“若一个反应可以分几步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同”参照它回答:
(1)使AgSO2和BgS在碱性溶液中作用,恰好完全反应生成
(2)按上述操作,铜的最高转化率是_____。
(3)有人设计让上述反应在密闭容器中进行,结果铜的转化率大大提高。问在密闭容器中反应,铜的最高转化率是________,其理由________________。
10、已知:AgF + Cl2 + H2O
→ AgCl + AgClO3 + HF +
O2(未配平)。若Cl2系数为a,则AgF的系数为_______,判断的依据是________;若AgClO3的系数为b,O2系数为c,则AgCl的系数为________,判断的依据________________。
11、我国北方地区的某些小盐湖,冬天湖底有纯碱晶体析出,夏天偶尔可见有食盐晶体析出。简述其原因。
12、在饱和Na2CO3的溶液中通入足量的CO2会有晶体析出,此晶体是_______;析出此晶体的原因是因为_______________。在饱和食盐水中先通入足量的氨,再通入足量的CO2会有NaHCO3晶体析出;若在饱和食盐水中先通入足量CO2,再通入氨气往往没有晶体析出,原因是___________________________。
13、托盘天平的两盘分别放上盛MgCl2和Na2CO3晶体的表面皿,两者质量相等,然后用玻璃罩把整个托盘天平罩上。经过一段时间,托盘天平发生倾斜,这是因为_________________________________。
14、无水CaCl2可用作干燥剂。有人认为夏天用CaCl2水溶液代替自来水喷洒柏油马路会得到更好的效果。其原因是____________________________。
15、CaCl2和冰的混合物是实验室常用的致冷剂,可获得-55℃的低温。在配制冷冻剂时,采用CaCl2·6H2O好,还是采用无水CaCl2好?为什么?
16、向盛沸水的小烧杯中滴入FeCl3溶液,然后将此溶液倒入U形管里并加外电场,最后加MgCl2溶液于U形管里。
简述上面实验过程中发生的现象_________________________,
写出有关的化学方程式_______________________________。
17、实验时,手指不慎划破,可从急救箱中取出FeCl3溶液应急止血,其原理是_______________________________________。
18、1840年盖斯根据一系列实验事实得出规律,他指出“若一个反应可以分几步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同”参照它回答:
(1)使AgSO2和BgS在碱性溶液中作用,恰好完全反应生成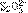 ,若使BgS在碱性溶液中发生反应,生成S2-和
,若使BgS在碱性溶液中发生反应,生成S2-和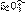 ,然后通AgSO2也生成
,然后通AgSO2也生成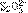 。各反应都相同条件下进行,则:
①反应热是否相同___________________。
②两种情况生成
。各反应都相同条件下进行,则:
①反应热是否相同___________________。
②两种情况生成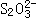 的物质的量是否相同__________,简述其理由________________。
(2)已知热化学方程式
C(固、金刚石) + O2(气) == CO2(气) + 395.41kJ
C(固、石墨) + O2(气) == CO2(气) + 393.51kJ
则金刚石转化为石墨时的热化学方程式为___________________;由热化方程式看来更稳定的碳的同素异形体是_____________________。
19、有a、b、c三种常见的短周期元素,它们之间两两结合构成化合物X,Y,Z。X,Y,Z之间也能相互发生反应,已知X是由a和b元素按原子个数比为1:1组成的化合物,其它元素形成的单质(仍用a,b,c表示)和组成的化合物之间反应关系如下(未配平)
①b + c → Y ②a + c → Z ③X + Y → m
④X + Z → C + n ⑤Y + Z → C + n
回答下列问题
(1)最有充分理由说明上述反应中一定属于氧化还原反应的是_________,其充分理由是_____________________________________。
(2)如果m是一种无色、粘稠的油状液体化合物,则X、Y、Z分别为______________,写出③④两反应的化学方程式_______________________,______________。
20、有原子序数依次增大的A,B,C,D,E五种短周期元素,它们可两两组成甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表:
的物质的量是否相同__________,简述其理由________________。
(2)已知热化学方程式
C(固、金刚石) + O2(气) == CO2(气) + 395.41kJ
C(固、石墨) + O2(气) == CO2(气) + 393.51kJ
则金刚石转化为石墨时的热化学方程式为___________________;由热化方程式看来更稳定的碳的同素异形体是_____________________。
19、有a、b、c三种常见的短周期元素,它们之间两两结合构成化合物X,Y,Z。X,Y,Z之间也能相互发生反应,已知X是由a和b元素按原子个数比为1:1组成的化合物,其它元素形成的单质(仍用a,b,c表示)和组成的化合物之间反应关系如下(未配平)
①b + c → Y ②a + c → Z ③X + Y → m
④X + Z → C + n ⑤Y + Z → C + n
回答下列问题
(1)最有充分理由说明上述反应中一定属于氧化还原反应的是_________,其充分理由是_____________________________________。
(2)如果m是一种无色、粘稠的油状液体化合物,则X、Y、Z分别为______________,写出③④两反应的化学方程式_______________________,______________。
20、有原子序数依次增大的A,B,C,D,E五种短周期元素,它们可两两组成甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表:
|
|
甲 |
乙 |
丙 |
丁 |
|
化合物中
各元素原
子个数比 |
A:C=
1:1 |
B:A=
1:2 |
D:E=
1:3 |
B:E=
1:4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数和;B原子最外层电子数比其次外层电子数多2个;在周期表中,C是E的邻族元素,化学性质活泼;D和E则位于同一周期,且D和E的原子序数之和为30。 (1)D和E同属哪一周期元素?推断依据是________________________。 (2)根据题目提供的条件,推断在周期表中的族序数所必要的条件是___________。 (3)向甲的水溶液中加MnO2,反应的化学方程式:____________________。 (4)已知乙的相对分子质量小于甲。在实验室常用什么方法制得乙?_____________。 (5)丙的水溶液呈酸性,与饱和的NaHCO3溶液反应会迅速产生大量气体和难溶物,有关离子方程式是________________________________。
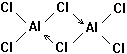 21、(1)已知气态氯化铝分子以双聚形
式存在,其中Al-Cl键为共价键,其结构式
如图所示。图中“Cl→Al;”表示Cl原子提
21、(1)已知气态氯化铝分子以双聚形
式存在,其中Al-Cl键为共价键,其结构式
如图所示。图中“Cl→Al;”表示Cl原子提
供了一对电子与Al原子共享。又已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却只是一元酸。可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因。请写出下面方程式右端的两种离子的表达式:
 (1)化工行业合成一种原子晶体--氮化碳,推测其化学式为__________,其硬度比金刚石______(填“大”或“小”),因为_____________________。
(1)化工行业合成一种原子晶体--氮化碳,推测其化学式为__________,其硬度比金刚石______(填“大”或“小”),因为_____________________。
简答题要求考生用简练的文字表述来回答问题。它具有取材广阔,内涵丰富,立意新颖,设问巧妙,思考容量大,能力要求高。而且常把识记、理解、实验、推论和计算等多方面、多层次的要求融于一题之中,往往具有一定的难度,对学生能力要求较高。
简答题是填空题的变形,即把空格变成问句,所以它们的功能基本相似。它不但用来考查考生的各种能力(理解能力、观察能力、思维能力、文字表达能力),还用来考查考生掌握知识的情况。不但用来考查考生是否“知其然”,还要考查考生能否“知其所以然”。
1、(1)托盘天平 (2)①MgCl2、AlCl3 ②Cu、Si ③烧杯、玻璃棒、漏斗、带铁圈的铁架台(或漏斗架)
(3)Mg2+ + 2OH- == Mg(OH)2
Al3+ + 3OH
- == Al(OH)3↓
Al(OH)3 + OH- == 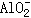 + 2H2O
(4)NaAlO2 + CO2 + 2H2O == Al(OH)3↓ + NaHCO
2Al(OH)3
+ 2H2O
(4)NaAlO2 + CO2 + 2H2O == Al(OH)3↓ + NaHCO
2Al(OH)3  Al2O3 + 3H2O
(9b/17a)×100%或(52.94b/a)% (5)①低,②高 高
2、(1)(NH4)2CO3
Al2O3 + 3H2O
(9b/17a)×100%或(52.94b/a)% (5)①低,②高 高
2、(1)(NH4)2CO3  2NH3↑ + CO2 ↑+ H2O
(2)碱石灰 因为另一种干燥剂无水CaCl2,只能吸收水,不能吸收CO2,不能使氨气完全净化
(3)2Na2O2 + 2H2O == 4NaOH + O2↑
(4)4NH3 + 5O2
2NH3↑ + CO2 ↑+ H2O
(2)碱石灰 因为另一种干燥剂无水CaCl2,只能吸收水,不能吸收CO2,不能使氨气完全净化
(3)2Na2O2 + 2H2O == 4NaOH + O2↑
(4)4NH3 + 5O2 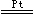 4NO + 6H2O 放热,可以看到戊中铂丝比开始反应时更加红热 (5)己中的红棕色气体颜色变浅,因为当浸入水中时,温度下降,红棕色的NO2能转化成无色N2O4,2NO2
4NO + 6H2O 放热,可以看到戊中铂丝比开始反应时更加红热 (5)己中的红棕色气体颜色变浅,因为当浸入水中时,温度下降,红棕色的NO2能转化成无色N2O4,2NO2  N2O4 + Q。降低温度时平衡向右移动,
[NO2]减小,[N2O4]增大,所以颜色变浅。
3、(1)②、④、⑤、⑥连接顺序;B接F,E接H,G接I(或K)
(2)2NaHCO3
N2O4 + Q。降低温度时平衡向右移动,
[NO2]减小,[N2O4]增大,所以颜色变浅。
3、(1)②、④、⑤、⑥连接顺序;B接F,E接H,G接I(或K)
(2)2NaHCO3  Na2CO3 + H2O + CO2↑
CO2 + Ba(OH)2 == BaCO3↓ + H2O
(3)当样品受热不再有气体产生时
(4)先将连接B与C的胶皮管卸下之后,再撤酒精灯。
(5)防止Ba(OH)2溶液吸收空气中的CO2而使实验准确度受影响。
(6)(53(11w-42a)/143w)×100%
4、(1)①⑨⑩⑥⑤③④⑧⑦②
(2)吸收SO3,放出等物质的量的SO2 (3)干燥SO2和O2
(4)保证气体将瓶中水压出进入量筒 (5)O2
3CuSO4
Na2CO3 + H2O + CO2↑
CO2 + Ba(OH)2 == BaCO3↓ + H2O
(3)当样品受热不再有气体产生时
(4)先将连接B与C的胶皮管卸下之后,再撤酒精灯。
(5)防止Ba(OH)2溶液吸收空气中的CO2而使实验准确度受影响。
(6)(53(11w-42a)/143w)×100%
4、(1)①⑨⑩⑥⑤③④⑧⑦②
(2)吸收SO3,放出等物质的量的SO2 (3)干燥SO2和O2
(4)保证气体将瓶中水压出进入量筒 (5)O2
3CuSO4  2SO2 + SO3 + O2 + 3CuO (6)F
5、(1)④③①②⑥ (2)HG、EF、AB、CD、JK
(3)黑色CuO变红,无水CuSO4变蓝,混合气体经过浓H2SO4,已将原水分除掉后,无水CuSO4变蓝,证明有水生成,进一步证明混合气体中有H2。
(4)(100(z2-z1)/9w)×100%
6、实验装置如下图所示。
2SO2 + SO3 + O2 + 3CuO (6)F
5、(1)④③①②⑥ (2)HG、EF、AB、CD、JK
(3)黑色CuO变红,无水CuSO4变蓝,混合气体经过浓H2SO4,已将原水分除掉后,无水CuSO4变蓝,证明有水生成,进一步证明混合气体中有H2。
(4)(100(z2-z1)/9w)×100%
6、实验装置如下图所示。
 按图装好实验装置,检验装置气密性并放好药品。
实验开始步骤:
(1)点燃A灯,轻轻旋转分液漏斗活塞,逐滴加入甲酸,使产生CO气体。
(2)待C管中的导管末端产生气泡均匀后,在D处点燃。
(3)点燃B灯,加热盛CuO的玻璃管,直到黑色氧化铜全部变红为止。
实验停止步骤:(1)熄灭B灯,使盛CuO的玻璃管冷却 (2)待盛CuO的玻璃管冷却后停止加甲酸,熄灭A灯 (3)拆除装置,倒出还原物。
7、(1)⑤③④⑥⑦②①⑧(⑥⑦顺序可对调) (2)大理石盐酸 (3)吸收混在O2中未反应的CO2 吸收CO2中混有的HCl
(4)a c
8、(1)①SO2 + I2 + 2H2O == H2SO4 + 2HI
②淀粉溶液,蓝色刚好褪去 ③w/5.08=cV/40
(2)①GADEF ②除去毒气SO2 ③不需要,因为气体通过NaHCO3溶液,SO2与NaHCO3反应产生CO2,改变了原气体中的CO2的量
④过滤,洗涤,干燥,称量 仪器:铁架台,过滤器,玻璃棒,烧杯,干燥器,天平。
9、(1)③②⑤ (2)②⑤⑥④① (3)2,使瓶内外压强相等。 (4)冒气泡 (5)用量筒量取33mL30%H2O2溶液加
入烧杯中,再加入67mL水(或加水稀释至100mL),搅拌均匀。
(6)ClO- + H2O2 == Cl- + O2↑ + H2O
10、(1)PH4I + NaOH
按图装好实验装置,检验装置气密性并放好药品。
实验开始步骤:
(1)点燃A灯,轻轻旋转分液漏斗活塞,逐滴加入甲酸,使产生CO气体。
(2)待C管中的导管末端产生气泡均匀后,在D处点燃。
(3)点燃B灯,加热盛CuO的玻璃管,直到黑色氧化铜全部变红为止。
实验停止步骤:(1)熄灭B灯,使盛CuO的玻璃管冷却 (2)待盛CuO的玻璃管冷却后停止加甲酸,熄灭A灯 (3)拆除装置,倒出还原物。
7、(1)⑤③④⑥⑦②①⑧(⑥⑦顺序可对调) (2)大理石盐酸 (3)吸收混在O2中未反应的CO2 吸收CO2中混有的HCl
(4)a c
8、(1)①SO2 + I2 + 2H2O == H2SO4 + 2HI
②淀粉溶液,蓝色刚好褪去 ③w/5.08=cV/40
(2)①GADEF ②除去毒气SO2 ③不需要,因为气体通过NaHCO3溶液,SO2与NaHCO3反应产生CO2,改变了原气体中的CO2的量
④过滤,洗涤,干燥,称量 仪器:铁架台,过滤器,玻璃棒,烧杯,干燥器,天平。
9、(1)③②⑤ (2)②⑤⑥④① (3)2,使瓶内外压强相等。 (4)冒气泡 (5)用量筒量取33mL30%H2O2溶液加
入烧杯中,再加入67mL水(或加水稀释至100mL),搅拌均匀。
(6)ClO- + H2O2 == Cl- + O2↑ + H2O
10、(1)PH4I + NaOH  PH3↑ + NaI + H2O
(2)Ⅰ、白磷;分解生成磷;
Ⅱ、2PH3 + 3Fe2(SO4)3 == 2P + 6FeSO4 +3H2SO4;还原
Ⅲ、此气体中除H2外,还有未反应完的具有剧毒的PH3及少量乙醚蒸气,不能随便排放。将气体燃烧可减少对空气的污染;
Ⅳ、利用乙醚蒸气密度大,先将装置中空气排尽,以保护PH3不致在装置中自燃,影响实验效果。
PH3↑ + NaI + H2O
(2)Ⅰ、白磷;分解生成磷;
Ⅱ、2PH3 + 3Fe2(SO4)3 == 2P + 6FeSO4 +3H2SO4;还原
Ⅲ、此气体中除H2外,还有未反应完的具有剧毒的PH3及少量乙醚蒸气,不能随便排放。将气体燃烧可减少对空气的污染;
Ⅳ、利用乙醚蒸气密度大,先将装置中空气排尽,以保护PH3不致在装置中自燃,影响实验效果。
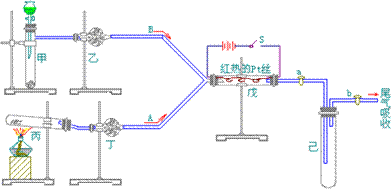
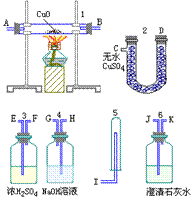
1、某铝合金中含有镁、铜、硅,为了使测定该合金,有人设计如下实验:
(1)称取样品ag,该实验使用的仪器名称为_______。
(2)将样品溶解于足量稀盐酸中,过滤,滤液中主要会有①____,滤渣中含有②____,该溶解、过滤实验中使用的仪器有③____。
(3)滤液中加入过量的NaOH溶液,过滤。写出该实验有关离子反应方程式____________。
(4)上述滤液中通过足量的CO2,过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称重为bg。有关化学方程式为___________。计算该样品的质量分数为_____。
(5)①若步骤(3)中,NaOH量不足,则测定结果偏_____(高、低、不影响)。②若步骤(4)中沉淀没有洗涤,则测定结果偏_____;若沉淀灼烧不充分,则结果偏_______。
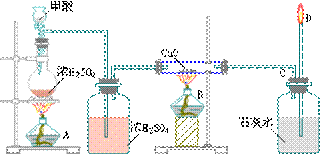
2、实验室用下列装置所示的流程进行气体性质实验。下图中用箭头表示气体的流向,A为一种纯净、干燥的气体,B是另一种气体,己中有红棕色气体出现。实验中所用的药品只能从下列物质中选取:
Na2CO3、NaHCO3、Na2O、Na2O2、NaCl、无水CaCl2、(NH4)2CO3,碱石灰等固体和蒸馏水。
 根据图中装置和现象回答:
(1)丙中发生反应的化学方程式______________________。
(2)丁中应选用的干燥剂是_____,为什么不选用所给的另一种干燥剂?
(3)甲中发生反应的化学方程式是______________________。
(4)戊中发生的主要反应的化学方程式______________。此反应是吸热反应还是放热反应?_____,估计可看到什么现象足以说明你的判断?_________。
(5)当己中充满红棕色气体后,停止给丙加热,并关闭a、b两个活塞。若将己浸入冰水中,则己中将有什么现象发生?简述发生此现象的原因。_____。
3、有一Na2CO3样品,其中只含 Na2CO3·10H2O和 NaHCO3,为测定样品中Na2CO3的质量分数,需做实验,请从下图中选用适当的实验装置,设计一个最简单的实验,测定样品中Na2CO3的质量分数。
根据图中装置和现象回答:
(1)丙中发生反应的化学方程式______________________。
(2)丁中应选用的干燥剂是_____,为什么不选用所给的另一种干燥剂?
(3)甲中发生反应的化学方程式是______________________。
(4)戊中发生的主要反应的化学方程式______________。此反应是吸热反应还是放热反应?_____,估计可看到什么现象足以说明你的判断?_________。
(5)当己中充满红棕色气体后,停止给丙加热,并关闭a、b两个活塞。若将己浸入冰水中,则己中将有什么现象发生?简述发生此现象的原因。_____。
3、有一Na2CO3样品,其中只含 Na2CO3·10H2O和 NaHCO3,为测定样品中Na2CO3的质量分数,需做实验,请从下图中选用适当的实验装置,设计一个最简单的实验,测定样品中Na2CO3的质量分数。
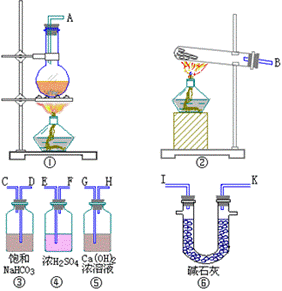 请填写下列空白:
(1)应选用的装置是(只写装置的标号):_____,所选用装置的连接顺序是(填接口的字母)________。
(2)写出在实验测定中发生的化学反应的化学方程式___________________。
(3)实验过程中当_____时,即可停止加热。
(4)停止加热时,正确的操作是_____。
(5)实验装置中盛碱石灰的U型管的作用是_____________。
(6)若取wg样品实验,经测定wg样品在加热时,可得agCO2,则wg样品中所含Na2CO3的质量分数为_____。
4、CuSO4在一定条件下发生如下分解:
请填写下列空白:
(1)应选用的装置是(只写装置的标号):_____,所选用装置的连接顺序是(填接口的字母)________。
(2)写出在实验测定中发生的化学反应的化学方程式___________________。
(3)实验过程中当_____时,即可停止加热。
(4)停止加热时,正确的操作是_____。
(5)实验装置中盛碱石灰的U型管的作用是_____________。
(6)若取wg样品实验,经测定wg样品在加热时,可得agCO2,则wg样品中所含Na2CO3的质量分数为_____。
4、CuSO4在一定条件下发生如下分解:
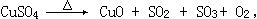 有人通过实验测定反应产生的SO2、SO3、O2的物质的量的方法,并经计算确定该条件下分解反应式各物质的系数。实验可能用到的仪器如下图所示:
有人通过实验测定反应产生的SO2、SO3、O2的物质的量的方法,并经计算确定该条件下分解反应式各物质的系数。实验可能用到的仪器如下图所示:
 实验测得的数据及有关结果如下:
①准确称量无水CuSO46.0克。
②测出量筒中水的体积后,折算成排水的气体标准状况下体积为280毫升。
③干燥管质量在实验结束时增加2.4克。
④实验结束时,装置F中的溶液变为NaHSO4溶液(不含其它杂质)。
请回答以下问题:
(1)按装置从左至右的方向,各仪器接口连接顺序(填编号)为_______________________。
(2)装置F的作用是_________________。
(3)装置D的作用是_________________。
(4)确定E的进、出口的原则是______________________________。
(5)首先应计算的物质是_______________,通过计算推断,该条件下反应的化学方程式是:_____________________。
(6)该实验设计中,可能给测定带来的误差最大的装置是(填字母代号)___。
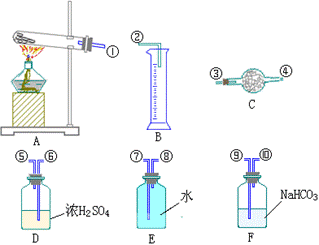
5、现有wg的混合气体,其主要成分是CO、H2和少量CO2、水蒸气。请从下图中选用适当的实验装置设计一个实验,以确认上述混合气体中含有CO和 H2,并计算H2的质量分数。
实验测得的数据及有关结果如下:
①准确称量无水CuSO46.0克。
②测出量筒中水的体积后,折算成排水的气体标准状况下体积为280毫升。
③干燥管质量在实验结束时增加2.4克。
④实验结束时,装置F中的溶液变为NaHSO4溶液(不含其它杂质)。
请回答以下问题:
(1)按装置从左至右的方向,各仪器接口连接顺序(填编号)为_______________________。
(2)装置F的作用是_________________。
(3)装置D的作用是_________________。
(4)确定E的进、出口的原则是______________________________。
(5)首先应计算的物质是_______________,通过计算推断,该条件下反应的化学方程式是:_____________________。
(6)该实验设计中,可能给测定带来的误差最大的装置是(填字母代号)___。
5、现有wg的混合气体,其主要成分是CO、H2和少量CO2、水蒸气。请从下图中选用适当的实验装置设计一个实验,以确认上述混合气体中含有CO和 H2,并计算H2的质量分数。
 (1)应选用的装置(只要求写
出右图中装置序号)_____;
(2)所选用的装置的连接顺序
应是(填各接口的字母,连接胶
管省略)。混合气体→_____;
(3)确认混合气体中含H2的实
验现象___________,理由是
(1)应选用的装置(只要求写
出右图中装置序号)_____;
(2)所选用的装置的连接顺序
应是(填各接口的字母,连接胶
管省略)。混合气体→_____;
(3)确认混合气体中含H2的实
验现象___________,理由是
_________。
(4)实验前分别称装置⑥为w1g,⑤为Mg,②为Zg。实验结束后再称各装置;⑥为w2g⑤为M2g,②为Z2g。若反应中生成物全被吸收,则wg混合气中的H2的质量分数为_____。
6、试设计一套实验装置来制备一氧化碳并还原氧化铜。说明操作步骤(一氧化碳用浓硫酸在微热条件下使甲酸脱水的方法制取)。
7、某课外活动小组学生模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图仪器来制取氧气并测量氧气的体积。
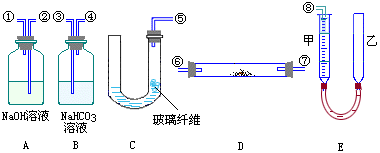 上图中量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水,甲管有刻度(0-50mL),供量气用;乙管可上下移动,调节液面高低。实验室可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。
试回答:
(1)上述装置的连接顺序是(填各接口的编号,其中连接胶管及夹持装置均省略):____________。
(2)装置C中放入的反应物是__________和__________。
(3)装置A的作用是____________装置B的作用是_____________。
(4)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数,求其差值的过程中,应注意______和______(填写字母编号)
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙两管液面相平。
8、喀麦隆的“杀人湖”(尼奥斯湖)曾于1986年使1800多名附近居民在一夜之间神秘死去,后经科学家考察发现,湖底有火山口,聚积了大量二氧化碳和二氧化硫等有毒气体,并发现在200米深的湖底,每立方米湖水竟溶解了8立方米的有毒气体。目前科技人员已找到一种有效的办法将湖底的有毒气体抽出并加以处理。回答:
(1)为了测定从湖底取出的水样中SO2的含量,可在一定量的水样中加入一定量的碘(过量),再用已知浓度的硫代硫酸钠溶液滴定过量的碘,该反应为:
2Na2S2O3 + I2 == 2Na2S4O6 + 2NaI
①碘和水样中SO2反应的化学方程式为_____________________。
②用硫代硫酸钠滴定过量碘时,应选用_______作指示剂,当溶液_____(填现象)便达到滴定的终点。
③若在20毫升水样中加入碘w克,用去V毫升cmol/L的Na2S2O3溶液,则水样中SO2浓度为_______________mol/L。
(2)为了测定从湖底抽出的有毒气体中CO2的含量,需将CO2变成沉淀,然后测其质量,通过计算求出CO2的含量。从下图中选择必要的装置(导管和胶管省略),设计实验,将CO2转变成沉淀。
上图中量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水,甲管有刻度(0-50mL),供量气用;乙管可上下移动,调节液面高低。实验室可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。
试回答:
(1)上述装置的连接顺序是(填各接口的编号,其中连接胶管及夹持装置均省略):____________。
(2)装置C中放入的反应物是__________和__________。
(3)装置A的作用是____________装置B的作用是_____________。
(4)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数,求其差值的过程中,应注意______和______(填写字母编号)
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙两管液面相平。
8、喀麦隆的“杀人湖”(尼奥斯湖)曾于1986年使1800多名附近居民在一夜之间神秘死去,后经科学家考察发现,湖底有火山口,聚积了大量二氧化碳和二氧化硫等有毒气体,并发现在200米深的湖底,每立方米湖水竟溶解了8立方米的有毒气体。目前科技人员已找到一种有效的办法将湖底的有毒气体抽出并加以处理。回答:
(1)为了测定从湖底取出的水样中SO2的含量,可在一定量的水样中加入一定量的碘(过量),再用已知浓度的硫代硫酸钠溶液滴定过量的碘,该反应为:
2Na2S2O3 + I2 == 2Na2S4O6 + 2NaI
①碘和水样中SO2反应的化学方程式为_____________________。
②用硫代硫酸钠滴定过量碘时,应选用_______作指示剂,当溶液_____(填现象)便达到滴定的终点。
③若在20毫升水样中加入碘w克,用去V毫升cmol/L的Na2S2O3溶液,则水样中SO2浓度为_______________mol/L。
(2)为了测定从湖底抽出的有毒气体中CO2的含量,需将CO2变成沉淀,然后测其质量,通过计算求出CO2的含量。从下图中选择必要的装置(导管和胶管省略),设计实验,将CO2转变成沉淀。
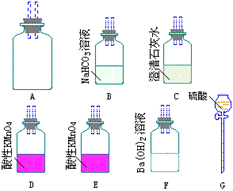 ①其所选装置的连接顺序是(按从上到下从左到右的顺序)_____________。
②将气体两次通过酸性高锰酸钾溶液的目的是_______________。
③是否需要选择装置B,为什么?____________________。
④为了得到沉淀物的质量还需进行的操作有______;还需要的仪器有______。
9、将氯气用导管通入较浓的NaOH和H2O2的混合液中,在导管口与混合液的接触处有闪烁的红光出现。这是因为通氯气在溶液里生成的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即变为普通氧分子,将多余的能量以红光放出。进行此实验,所用的仪器导管如下图所示。根据要求填空
①其所选装置的连接顺序是(按从上到下从左到右的顺序)_____________。
②将气体两次通过酸性高锰酸钾溶液的目的是_______________。
③是否需要选择装置B,为什么?____________________。
④为了得到沉淀物的质量还需进行的操作有______;还需要的仪器有______。
9、将氯气用导管通入较浓的NaOH和H2O2的混合液中,在导管口与混合液的接触处有闪烁的红光出现。这是因为通氯气在溶液里生成的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即变为普通氧分子,将多余的能量以红光放出。进行此实验,所用的仪器导管如下图所示。根据要求填空
|
编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
|
导
管
及
仪
器 |
 |
 |
 |
 |
 |
 |
(1)组装氯气发生器时,应选用的仪器及导管(填写图中编号)是_____。
(2)实验进行中,按气流方向从左到右的顺序,气体流经各仪器及导管的编号依次是_________________________。
(3)仪器上①的橡皮塞上应有_____个孔,原因是_____________。
(4)实验时,仪器①中除观察到红色外还有______________。
(5)实验需用约10%的H2O2溶液100毫升,用现市售30%(密度近似为1克/厘米3)H2O2来配制,其具体配制方法是_________________。
(6)实验时仪器①中ClO-与H2O2反应的离子方程式是_____。
10、磷化氢(PH3)是一种无色剧毒的气体(沸点为-89.7℃)。夏夜,坟场附近游荡着的蓝莹莹“鬼火”,就是PH3的自燃现象。PH3可以由碘化磷(PH4I)与强碱反应来制取,其原理类似于实验室制取氢气。现用下图所示装置进行PH3的制取和性质实验。
 (1)实验室用PH4I和烧碱反应制取PH3的化学方程式:_____。
(2)实验开始时,先从分液漏斗往盛有碘化磷的烧瓶A中加入适量乙醚(乙醚为无色液体,沸点是34.5℃,微溶于水,与Fe2(SO4)3溶液不发生反应)。微热数分钟后,再从分液漏斗往烧瓶中加入一定浓烧碱溶液,继续加热。在B处用电加热器控制硬质玻璃管温度在300℃左右。实验中可观察到:①在用湿布裹着的C管处有白色蜡状固体生成;②D试管中Fe2(SO4)3溶液由黄褐色变成淡绿色,同时也有白色蜡状固体生成;③E处点燃气体,火焰呈现淡蓝色。
Ⅰ、C管处白色蜡状固体是_________,这一事实说明PH3受热_____________;
Ⅱ、D试管中发生反应的化学方程式式为: _________________________________________;此反应说明PH3具有_____性;
Ⅲ、E处导出的气体必须点燃的原因是________________________________;
Ⅳ、实验开始时,先往烧瓶A中加入适量乙醚并微热,其目的是________________________。
(1)实验室用PH4I和烧碱反应制取PH3的化学方程式:_____。
(2)实验开始时,先从分液漏斗往盛有碘化磷的烧瓶A中加入适量乙醚(乙醚为无色液体,沸点是34.5℃,微溶于水,与Fe2(SO4)3溶液不发生反应)。微热数分钟后,再从分液漏斗往烧瓶中加入一定浓烧碱溶液,继续加热。在B处用电加热器控制硬质玻璃管温度在300℃左右。实验中可观察到:①在用湿布裹着的C管处有白色蜡状固体生成;②D试管中Fe2(SO4)3溶液由黄褐色变成淡绿色,同时也有白色蜡状固体生成;③E处点燃气体,火焰呈现淡蓝色。
Ⅰ、C管处白色蜡状固体是_________,这一事实说明PH3受热_____________;
Ⅱ、D试管中发生反应的化学方程式式为: _________________________________________;此反应说明PH3具有_____性;
Ⅲ、E处导出的气体必须点燃的原因是________________________________;
Ⅳ、实验开始时,先往烧瓶A中加入适量乙醚并微热,其目的是________________________。
附答案
9、(1)CH3CH2OH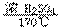 CH2=CH2↑+H2O
CH2=CH2↑+H2O
CH2=CH2+Br→CH2BrCH2Br (2)b中水面会下降,玻璃管中的水柱会上升,甚至溢出。 (3)除去乙烯中带出的酸性气体。 (4)①乙烯发生(或通过液溴)速度过快。 ②实验过程中,乙醇和浓H2SO4的混合液没有迅速达到170℃。 10、(1)增加一种反应物的量,有利于酯化反应向正反应方向进行 (2)蒸出生成物,有利于酯化反应向正方向进行 (3)B (4)除去粗产品中的乙醇 (5)除去产品中的水
6、(1)2CH3CH2OH+O2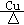 2CH3CHO+2H2O
2CH3CHO+2H2O
(2)白色粉末变为蓝色 CuSO4与H2O结合生成CuSO4·5H2O
(3)产生红色沉淀 CH3CHO+2Cu(OH)2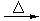 CH3COOH+Cu2O↓+2H2O
7、(1)B (2)C (3)增大接触面,使反应完全
(4)0.092m/22.4ρV (5)AB
8、(1)乙,冷却充分,离火源远,安全 (2)插入液体中
(3)乙醇,饱和Na2CO3溶液,分液漏斗。
CH3COOH+Cu2O↓+2H2O
7、(1)B (2)C (3)增大接触面,使反应完全
(4)0.092m/22.4ρV (5)AB
8、(1)乙,冷却充分,离火源远,安全 (2)插入液体中
(3)乙醇,饱和Na2CO3溶液,分液漏斗。
2、(1)CH3CH2OH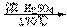 CH2=CH2↑+H2O
CH2=CH2↑+H2O
(2)催化剂和脱水剂
(3)反应液面以下
(4)以免反应混合液剧烈跳动
(5)减少副产物,在170℃时反应的产物才是乙烯
(6)浓H2SO4有脱水性,在加热时,使酒精碳化而变黑
(7)不同。乙烯与溴水中Br2发生加成反应而使溴水褪色,KMnO4是氧化乙烯而本身被还原使得溶液褪色
3、(1)C、I、J、G、H、F、E、D
(2)不能,因为反应剧烈,放出量多,生成Ca(OH)2呈糊状,易堵塞球形漏斗的下端
(3)饱和食盐水 (4)64(336+V)/224w%
4、(1)苯、液溴和铁屑,导气管兼冷凝器
(2)反应生成的溴化氢遇水蒸气所形成
(3)浅黄色沉淀 (4)褐、溴
(5)C6H6+Br2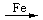 C6H5Br+HBr
5、(1)先将浓硝酸注入容器中,再慢慢注入浓H2SO4,并及时搅拌和冷却
(2)将反应容器放在50-60℃的水浴中加热
(3)分液漏斗 (4)除去粗产品中残留的酸
(5)大;苦杏仁
C6H5Br+HBr
5、(1)先将浓硝酸注入容器中,再慢慢注入浓H2SO4,并及时搅拌和冷却
(2)将反应容器放在50-60℃的水浴中加热
(3)分液漏斗 (4)除去粗产品中残留的酸
(5)大;苦杏仁
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com