
题目列表(包括答案和解析)
4、法医用的指纹实验,常用AgNO3溶液喷洒指纹,用化学方程式表示其原理是
(1)____________________________ (2)_________________________。
3、液氯可用钠瓶贮存,因为 ________________________,装碘片的瓶子不用铁盖子,是因为 ________________________。
2、漂白粉的成分是Ca(ClO)2和CaCl2,其有效成分是Ca(ClO)2。现已将漂白粉这一产品升级换代成漂粉精。漂粉精的主要成分是Ca(ClO)2。请你从化学角度分析一下,为什么漂白粉会被淘汰 ____________________________________。
1、将下列物质分别滴入新制的氯水中,有何现象发生?用简要的文字和化学反应方程式式说明。
(1)紫色石蕊试液 ____________________________。
(2)AgNO3溶液 ____________________________。
(3)Na2CO3溶液 ____________________________。
(4)FeCl2溶液 ____________________________。
(5)润湿的有色布条 ____________________________。
1、(1)不正确。从微观上讲,物质是由微粒构成的。但构成物质的微粒不仅只有分子,还有离子,原子也是构成物质的基本微粒。
(2)不正确。单质的概念是由同种元素组成的纯净物。物质既可以是纯净物,也可以是混合物,所以不严密。由同种元素可以形成多种单质,氧气和臭氧的混合物是由同种元素组成,但不是单质。
(3)不正确。酸性氧化物都是酸酐,但并不是所有的酸性氧化物都能直接和水反应生成相应的酸。例如SiO2是H2SiO3的酸酐,但SiO2不与水反应生成相应的H2SiO3。
(4)碱性氧化物肯定是金属氧化物的说法正确,但金属氧化物是碱性氧化物的说法不正确。例如Na2O2是氧化物,Al2O3是两性氧化物,Mn2O7是酸性氧化物,它们都是金属氧化物,但不是碱性氧化物。
(5)都不正确。例如Mn2O7、CrO3等变价金属的高价氧化物都是酸性氧化物,但不是非金属氧化物。又如H2O、NO、H2O2等氧化物都是非金属氧化物,但不是酸性氧化物。
(6)正确。同种元素的不同种原子,由于它们的核电荷数相同,因而它们的化学性质几乎完全相同。
(7)不正确。这种说法错在没有指出“微粒”的种类,只有当微粒是原子时,才是正确的,否则不正确。例如: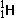 和
和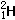 属于同种元素,
属于同种元素,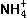 和Na+具有相同质子数,就不属于同种元素。
(8)不正确,例如乙醇(CH3CH2OH)和甲醚(CH3OCH3),它们的分子组成相同,均为C2H6O,但它们互为同分异构体,不属于同种物质。
(9)不正确。同素异形体间的相互转变,如O2变为O3,或O3变为O2,都是有单质生成的反应,却不属于氧化还原反应。
(10)不正确。弱酸的酸式盐NaHCO3,既可与酸反应放出CO2,又可与碱反应生成Na2CO3和水,但不是两性化合物。只有Al2O3、Al(OH)3、NH2CH2COOH等化合物才是两性化合物。
2、①O3F2。根据阿伏加德罗定律,A物质分解反应的化学方程式为:2A =
3O2 + 2F2根据质量守恒定律,A分子组成应为O3F2。
和Na+具有相同质子数,就不属于同种元素。
(8)不正确,例如乙醇(CH3CH2OH)和甲醚(CH3OCH3),它们的分子组成相同,均为C2H6O,但它们互为同分异构体,不属于同种物质。
(9)不正确。同素异形体间的相互转变,如O2变为O3,或O3变为O2,都是有单质生成的反应,却不属于氧化还原反应。
(10)不正确。弱酸的酸式盐NaHCO3,既可与酸反应放出CO2,又可与碱反应生成Na2CO3和水,但不是两性化合物。只有Al2O3、Al(OH)3、NH2CH2COOH等化合物才是两性化合物。
2、①O3F2。根据阿伏加德罗定律,A物质分解反应的化学方程式为:2A =
3O2 + 2F2根据质量守恒定律,A分子组成应为O3F2。
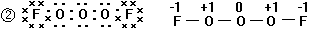 3、不溶于酸,能溶于碱生成盐和水的金属氧化物是酸性氧化物;不溶于碱,能溶于酸生成盐和水的氧化物是碱性氧化物;既能溶于酸又能溶于碱且生成盐和水的金属氧化物是两性氧化物。
3、不溶于酸,能溶于碱生成盐和水的金属氧化物是酸性氧化物;不溶于碱,能溶于酸生成盐和水的氧化物是碱性氧化物;既能溶于酸又能溶于碱且生成盐和水的金属氧化物是两性氧化物。
 (2)①反应前后质量不变,同温同压时气体密度与气体体积成反比
(2)①反应前后质量不变,同温同压时气体密度与气体体积成反比
7/(3x/2+3y/2+4-3y/4)=1-3/10 y=8-2x②x=2时,y=4,N2H4。
5、(1)若b<e,硒的相对原子质量大;
(2)32de/bd 或 32e(100-a-b)/b(100-d-e)
6、溴的相对原子质量或式量是氯、碘的平均值。不能,因不知道氯、溴、碘的相对原子质量。若已知氯、溴、碘的相对原子质量及在某温度和压强下气体的密度,则可知其式量或化式。
7、测定氩气的密度,计算它的式量,若式量与相对原子质量之比为1,即证实氩是单原子分子。
8、(1)a=b (2)27/28a=11/12b (3)27/28a=b-2m(4)不能;若天平平衡,则a-2m=(11/12)b,∵a>56m,则a=(11/12)b+2m>56m,解得b>648m/11,这与b<24m矛盾。
9、(1)2、2,1、2、1、2、1。(NH4)2SO4; (2)50%;(3)100%,密闭容器中SO2中压强增大,溶解量增多,可将CuSO4还原为铜。
10、2a,根据氯原子数反应前后相等的原则,AgCl与AgCO3系数之和为2a,则AgF的系数为2a;5b+4c氧化还原反应中,氧化剂得电子总数与还原剂失电子总数必相等。
11、盐湖中溶有大量的Na2CO3和NaCl,Na2CO3的溶解度受温度影响较大,NaCl的溶解度受温度影响较小。冬天气温低,Na2CO3的溶解度小,湖水容易形成Na2CO3的饱和溶液,所以冬天会有纯碱晶体析出;夏天气温高,湖水大量蒸发,易形成NaCl的饱和溶液,所以夏天有NaCl晶体析出。
12、NaHCO3 NaHCO3溶解度比Na2CO3小 CO2的溶解度小,溶液中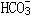 浓度低。
13、Na2CO3晶体易失水风化使其质量减轻,MgCl2晶体易吸水潮解使其质量增重。
14、夏天气温高,路面喷洒的水易蒸发,若喷洒CaCl2水溶液,水蒸发后,因CaCl2具有强吸水性,能从空气中吸收水分使路面保持湿润。
15、用CaCl2·6H2O更好,因无水CaCl2水合时要放出热量,降低致冷效果。
16、有红褐色胶体
浓度低。
13、Na2CO3晶体易失水风化使其质量减轻,MgCl2晶体易吸水潮解使其质量增重。
14、夏天气温高,路面喷洒的水易蒸发,若喷洒CaCl2水溶液,水蒸发后,因CaCl2具有强吸水性,能从空气中吸收水分使路面保持湿润。
15、用CaCl2·6H2O更好,因无水CaCl2水合时要放出热量,降低致冷效果。
16、有红褐色胶体 ,发生了电泳和凝聚。
17、FeCl3是电解质,它使血液中的蛋白质胶体很快凝结而止血。
18、(1)相同 (2)相同。因反应物的始态均相同,且终态产物也完全相同,虽过程不同,但根据盖斯定律热量相同,故两种情况下生成的
,发生了电泳和凝聚。
17、FeCl3是电解质,它使血液中的蛋白质胶体很快凝结而止血。
18、(1)相同 (2)相同。因反应物的始态均相同,且终态产物也完全相同,虽过程不同,但根据盖斯定律热量相同,故两种情况下生成的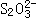 的物质的量也相同。
(2)C(固、金刚石)=C(固、石墨)+1.90kJ 石墨。
19、(1)①②④⑤ 这些反应中有单质生成或有单质参加反应
(2)H2O、SO2、H2S H2O2+SO2==H2SO4 H2O2+H2S==S+2H2O。
20、(1)D和E同属第三周期元素。因为它们的原子序数平均值为30/2=15,正好落在第三周期元素原子序数(11-18)值的范围。
(2)①化合物丙中各原子个数比D:E=1:3;②D和E的原子序数之和为30;
(3)
的物质的量也相同。
(2)C(固、金刚石)=C(固、石墨)+1.90kJ 石墨。
19、(1)①②④⑤ 这些反应中有单质生成或有单质参加反应
(2)H2O、SO2、H2S H2O2+SO2==H2SO4 H2O2+H2S==S+2H2O。
20、(1)D和E同属第三周期元素。因为它们的原子序数平均值为30/2=15,正好落在第三周期元素原子序数(11-18)值的范围。
(2)①化合物丙中各原子个数比D:E=1:3;②D和E的原子序数之和为30;
(3)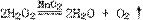
 氮原子半径<碳原子半径,C-N键长<C-C键长,C-N键强度>C-C键强度。
22、(1)C;(2)对,从反应②③可看出碘在反应中没有消耗(质量和化学性质均不变),在碘的存在下过氧化氢分解放出氧气的速率加快。(3)HIO>H2O2>I2。
23、①a>4k ②D。
24、(1)两组物质的熔点从左到右第Ⅰ组降低,第Ⅱ组升高,且第Ⅰ组普遍高于第Ⅱ组。
(2)第Ⅰ组均是离子晶体,第Ⅱ组都是分子晶体,Ⅰ组从左到右Na+→Cs+半径增大,键能减小,Ⅱ组组成结构相似,分子量增大,熔点升高。
25、气体体积缩小,溶液呈浅绿色 气体和溶液均变为无色氯水中有如下平衡
氮原子半径<碳原子半径,C-N键长<C-C键长,C-N键强度>C-C键强度。
22、(1)C;(2)对,从反应②③可看出碘在反应中没有消耗(质量和化学性质均不变),在碘的存在下过氧化氢分解放出氧气的速率加快。(3)HIO>H2O2>I2。
23、①a>4k ②D。
24、(1)两组物质的熔点从左到右第Ⅰ组降低,第Ⅱ组升高,且第Ⅰ组普遍高于第Ⅱ组。
(2)第Ⅰ组均是离子晶体,第Ⅱ组都是分子晶体,Ⅰ组从左到右Na+→Cs+半径增大,键能减小,Ⅱ组组成结构相似,分子量增大,熔点升高。
25、气体体积缩小,溶液呈浅绿色 气体和溶液均变为无色氯水中有如下平衡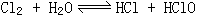 ,由于HClO逐渐分解,平衡不断右移,最终Cl2耗尽而转化为O2,导致气体体积缩小和黄绿色消失。
26、①反应开始时,2KClO3+6NaHSO3==3Na2SO4+2KCl+3H2SO4,由于H2SO4[H+]增大,浓度减小,速度减慢。
27、S燃烧时主要生成SO2,在高温情况下可有少量2SO2+O2=2SO3+Q发生,但该反应系放热反应,温度高不利于SO3的生成,纯氧中单位时间内燃烧放出的热量多,温度高,因此SO2的转化率将更低。
28、反应放热,溶液温度升高,反应速率加快,盐酸浓度减小,反应速率减慢。
29、增加,加入含37Cl较多的Cl2后,平衡左移,虽未重新建立平衡,但37Cl较多的PCl5也在分解,所以,PCl3中,37Cl的百分含量也会增加。
30、D 由于气体分子数目和质量同时变化。即增大压强平衡向逆反应方向移动,产生了C(固),从而气体的质量减小,而气体的物质的量也减小了 5z≤3x+8y。
31、(1)在850℃时,KCl、NaCl、Na均为液态,只有K为气态。(2)依据平衡移动原理,将K变为气态脱离反应条件,减少了生成物浓度,使可逆反应不断向正方向移动。
32、(1)放热反应 (2)在500℃以下时,反应并未达到平衡,正反应速度始终大于逆反应速度,所以温度升高,混合物(非平衡状态)中C的百分含量也增大。
(3)在500℃以上时,反应处于平衡状态后的移动。因为正反应是放热反应,所以温度升高,平衡向逆反应方向移动,平衡时混合物中C的百分含量逐渐减少。
33、(1)1,1,2,1,4;(2)温度升高,反应速度增大
(3)增大,NaNO2是反应物中的氧化剂,增大反应物浓度,平衡向生成物方向移动;由③知,增大NaOH浓度,平衡向逆方向移动,抑制Fe3O4的生成。
34、可以,由于该反应是一个反应前后气体体积不变的反应,压强增大到2倍时,I2(气)及其它物质的物质的量均不变,但浓度却增大到2倍,故可以看到I2(气)的紫色加深。
35、合成氨的反应是一个气体体积减小的反应,高压有利于平衡向右移动,而制SO3反应
,由于HClO逐渐分解,平衡不断右移,最终Cl2耗尽而转化为O2,导致气体体积缩小和黄绿色消失。
26、①反应开始时,2KClO3+6NaHSO3==3Na2SO4+2KCl+3H2SO4,由于H2SO4[H+]增大,浓度减小,速度减慢。
27、S燃烧时主要生成SO2,在高温情况下可有少量2SO2+O2=2SO3+Q发生,但该反应系放热反应,温度高不利于SO3的生成,纯氧中单位时间内燃烧放出的热量多,温度高,因此SO2的转化率将更低。
28、反应放热,溶液温度升高,反应速率加快,盐酸浓度减小,反应速率减慢。
29、增加,加入含37Cl较多的Cl2后,平衡左移,虽未重新建立平衡,但37Cl较多的PCl5也在分解,所以,PCl3中,37Cl的百分含量也会增加。
30、D 由于气体分子数目和质量同时变化。即增大压强平衡向逆反应方向移动,产生了C(固),从而气体的质量减小,而气体的物质的量也减小了 5z≤3x+8y。
31、(1)在850℃时,KCl、NaCl、Na均为液态,只有K为气态。(2)依据平衡移动原理,将K变为气态脱离反应条件,减少了生成物浓度,使可逆反应不断向正方向移动。
32、(1)放热反应 (2)在500℃以下时,反应并未达到平衡,正反应速度始终大于逆反应速度,所以温度升高,混合物(非平衡状态)中C的百分含量也增大。
(3)在500℃以上时,反应处于平衡状态后的移动。因为正反应是放热反应,所以温度升高,平衡向逆反应方向移动,平衡时混合物中C的百分含量逐渐减少。
33、(1)1,1,2,1,4;(2)温度升高,反应速度增大
(3)增大,NaNO2是反应物中的氧化剂,增大反应物浓度,平衡向生成物方向移动;由③知,增大NaOH浓度,平衡向逆方向移动,抑制Fe3O4的生成。
34、可以,由于该反应是一个反应前后气体体积不变的反应,压强增大到2倍时,I2(气)及其它物质的物质的量均不变,但浓度却增大到2倍,故可以看到I2(气)的紫色加深。
35、合成氨的反应是一个气体体积减小的反应,高压有利于平衡向右移动,而制SO3反应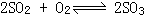 尽管也是一个气体体积减小的反应,但在常压下SO2的转化率已经较高。
36、V1≠V2 增大Ag+或Ac-的浓度,都有使平衡向正反应方向移动,降低AgAc的溶解度。
37、(1)增加;(2)加水,加AgNO3溶液。
38、①黄色;②橙红色;③向右移动,变为无色。
39、在MgCl2溶液中加入氨水时,产生的白沉淀是Mg(OH)2。Mg(OH)2是不溶于水的,在溶液中有溶解平衡、电离平衡同时存在,
尽管也是一个气体体积减小的反应,但在常压下SO2的转化率已经较高。
36、V1≠V2 增大Ag+或Ac-的浓度,都有使平衡向正反应方向移动,降低AgAc的溶解度。
37、(1)增加;(2)加水,加AgNO3溶液。
38、①黄色;②橙红色;③向右移动,变为无色。
39、在MgCl2溶液中加入氨水时,产生的白沉淀是Mg(OH)2。Mg(OH)2是不溶于水的,在溶液中有溶解平衡、电离平衡同时存在,
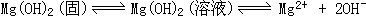 。当分别加入NH4Cl、CH3COONH4、NaHCO3、NH4HCO3等强电解质后,
。当分别加入NH4Cl、CH3COONH4、NaHCO3、NH4HCO3等强电解质后,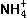 、
、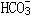 均可消耗其电离产生的OH-,使电离平衡向右移动,故白色沉淀均可消失。
40、冰醋酸是共价化合物,不存在自由移动的离子,不导电。当加入少量水时,冰醋酸电离
均可消耗其电离产生的OH-,使电离平衡向右移动,故白色沉淀均可消失。
40、冰醋酸是共价化合物,不存在自由移动的离子,不导电。当加入少量水时,冰醋酸电离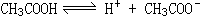 ,溶液中产生自由移动的离子,导电性逐渐增大。继续稀释,电离度略有增大,但溶液体积增大,离子浓度反而降低,导电性减弱。当加入NaOH溶液时由于发生中和反应,生成强电解质CH3COONa,CH3COONa在溶液中完全电离,使离子浓度增大,因此导电性增强。
41、(1)a=[H+]/c=10-3/0.2=0.5% (2)NH3·H2O和CH3COOH为弱电解质,但NH3·H2O+CH3COOH=CH3COONH4+H2O,其中CH3COOH为强电解质,随CH3COONH4的量的增加,溶液的导电性逐渐增强,当氨水和醋酸恰好反应时,溶液的导电性最强,继续加氨水,溶液体积变大,会使离子浓度下降,使导电性减弱。
42、(1)< 两溶液稀释相同的倍数后,由于强酸完全电离,B中的H+数目不会变,强酸稀释后电离度增大,使A中的H+数目增大。因开始时,A、B的pH值相等,故稀释后pH(A)<pH(B);
(2)< 中和反应的实质是H++OH-==H2O。因稀释后A中的[H+]比B中的[H+]大,且A中未电离的一元弱酸分子也可(继续电离出H+)与NaOH溶液中和,故需B的体积大。
43、已知室温时,纯水中的[H+]=[OH-]=10-7mol/L,又因水的离解
,溶液中产生自由移动的离子,导电性逐渐增大。继续稀释,电离度略有增大,但溶液体积增大,离子浓度反而降低,导电性减弱。当加入NaOH溶液时由于发生中和反应,生成强电解质CH3COONa,CH3COONa在溶液中完全电离,使离子浓度增大,因此导电性增强。
41、(1)a=[H+]/c=10-3/0.2=0.5% (2)NH3·H2O和CH3COOH为弱电解质,但NH3·H2O+CH3COOH=CH3COONH4+H2O,其中CH3COOH为强电解质,随CH3COONH4的量的增加,溶液的导电性逐渐增强,当氨水和醋酸恰好反应时,溶液的导电性最强,继续加氨水,溶液体积变大,会使离子浓度下降,使导电性减弱。
42、(1)< 两溶液稀释相同的倍数后,由于强酸完全电离,B中的H+数目不会变,强酸稀释后电离度增大,使A中的H+数目增大。因开始时,A、B的pH值相等,故稀释后pH(A)<pH(B);
(2)< 中和反应的实质是H++OH-==H2O。因稀释后A中的[H+]比B中的[H+]大,且A中未电离的一元弱酸分子也可(继续电离出H+)与NaOH溶液中和,故需B的体积大。
43、已知室温时,纯水中的[H+]=[OH-]=10-7mol/L,又因水的离解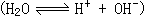 是吸热反应,故温度升高到80℃,电离度增大,致使[H+]=[OH-]>10-7mol/L,即pH<7。
44、(1)不正确。
(2)若溶液不显中性,则H+或OH-被稀释,测出的不为溶液中H+或OH-对应的pH值;可能有误差,当溶液为中性时则不产生误差。
(3)测得的pH值H3PO4较H2SO4小,因为在稀释过程中,H3PO4继续电离产生H+,使得其溶液中[H+]较H2SO4溶液的[H+]大。
45、有 例如稀释盐酸,溶液中[OH-]增大。
46、减小 NaOH与空气中的CO2反应,造成NaOH浓度减少,故溶液的pH值减小。(1)VA=VB (2)VA<VB
47、①K2CO3;尽管加热过程促进K2CO3水解,但随着水的挥发,生成KHCO3和KOH反应后仍为K2CO3;
②明矾;尽管Al3+水解。由于H2SO4为高沸点酸,故最后仍然是结晶水合物明矾;
③Mg(OH)2;Mg(HCO3)2在溶液中受热分解,生成的MgCO3在溶液中受热水解生成Mg(OH)2沉淀。
④Na2SO4和Na2SO3混合物;Na2SO3在蒸干的过程中不断被空气中氧气氧化而变成Na2SO4;
⑤Al(OH)3和Al2O3;Al3+水解,HCl挥发,得Al(OH)3,Al(OH)3部分分解为Al2O3;
⑥10mol/LH2SO4溶液;HCl挥发后剩余为硫酸溶液。
48、(1)NaOH、HNO3。 NaNO2、NH4NO3。
(2)由于HNO3在溶液电离出H+,使水的电离平衡
是吸热反应,故温度升高到80℃,电离度增大,致使[H+]=[OH-]>10-7mol/L,即pH<7。
44、(1)不正确。
(2)若溶液不显中性,则H+或OH-被稀释,测出的不为溶液中H+或OH-对应的pH值;可能有误差,当溶液为中性时则不产生误差。
(3)测得的pH值H3PO4较H2SO4小,因为在稀释过程中,H3PO4继续电离产生H+,使得其溶液中[H+]较H2SO4溶液的[H+]大。
45、有 例如稀释盐酸,溶液中[OH-]增大。
46、减小 NaOH与空气中的CO2反应,造成NaOH浓度减少,故溶液的pH值减小。(1)VA=VB (2)VA<VB
47、①K2CO3;尽管加热过程促进K2CO3水解,但随着水的挥发,生成KHCO3和KOH反应后仍为K2CO3;
②明矾;尽管Al3+水解。由于H2SO4为高沸点酸,故最后仍然是结晶水合物明矾;
③Mg(OH)2;Mg(HCO3)2在溶液中受热分解,生成的MgCO3在溶液中受热水解生成Mg(OH)2沉淀。
④Na2SO4和Na2SO3混合物;Na2SO3在蒸干的过程中不断被空气中氧气氧化而变成Na2SO4;
⑤Al(OH)3和Al2O3;Al3+水解,HCl挥发,得Al(OH)3,Al(OH)3部分分解为Al2O3;
⑥10mol/LH2SO4溶液;HCl挥发后剩余为硫酸溶液。
48、(1)NaOH、HNO3。 NaNO2、NH4NO3。
(2)由于HNO3在溶液电离出H+,使水的电离平衡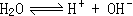 向逆方向移动,故水的电离度减小。而NH4NO3在溶液中电离出的
向逆方向移动,故水的电离度减小。而NH4NO3在溶液中电离出的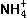 能与水电离出的OH-结合成弱电解质NH3 ·H2O,从而促进水的电离,故水的电离度增大。(3)a1=a2。
49、小于3.1大于4.4 增大 [CH3COO-]使[H+]减少,pH值增大。
50、不对 常温时pH+pOH==4,正常人体温为36.5℃左右,比常温高,使pH+pOH<14,则pOH值应小于6.66-6.55。
51、Al2(SO4)3+6NaHCO3==2Al(OH)3+6CO2↑+3Na2SO4; 1:6由1mol
能与水电离出的OH-结合成弱电解质NH3 ·H2O,从而促进水的电离,故水的电离度增大。(3)a1=a2。
49、小于3.1大于4.4 增大 [CH3COO-]使[H+]减少,pH值增大。
50、不对 常温时pH+pOH==4,正常人体温为36.5℃左右,比常温高,使pH+pOH<14,则pOH值应小于6.66-6.55。
51、Al2(SO4)3+6NaHCO3==2Al(OH)3+6CO2↑+3Na2SO4; 1:6由1mol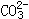 转化为1molCO2需2molH+,H+由Al3+提供,现因Al3+量不变,只能生成
转化为1molCO2需2molH+,H+由Al3+提供,现因Al3+量不变,只能生成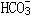 ,没有CO2,喷不出泡沫和表层NaHCO3反应生成Al(OH)3后,阻碍反应的进行 Al3+水解产生的H+会腐蚀铁筒。
52、[H+]=10-3mol/L的酸是浓的弱酸,[OH-]=10-3mol/L的碱是稀的强碱,两者等体积混合后酸过量,所以混合溶液的pH<7。
53、NaClO 不能 NaClO水解呈碱性,
,没有CO2,喷不出泡沫和表层NaHCO3反应生成Al(OH)3后,阻碍反应的进行 Al3+水解产生的H+会腐蚀铁筒。
52、[H+]=10-3mol/L的酸是浓的弱酸,[OH-]=10-3mol/L的碱是稀的强碱,两者等体积混合后酸过量,所以混合溶液的pH<7。
53、NaClO 不能 NaClO水解呈碱性, ,使铝溶解,此外HClO的强氧化性也能氧化铝。
54、(1)D; (2)加入CuSO4后,构成Fe-Ag原电池,Fe溶解,减轻,Cu2+在银圈上得电子,沉积在其上,增重。
55、(1)甲=乙=丙;(2)甲=乙<丙;(3)甲>乙>丙;
(4)对于丙,形成Zn-Cu原电池,使反应速率加快。
56、钢铁在通常情况下易发生的是吸氧腐蚀,Na2SO3具有较强的还原性,能与水中溶解的氧反应:2Na2SO3+O2==2Na2SO4防止输水管发生吸氧腐蚀。
57、化学腐蚀,2Al+6CH3COOH==2Al(Ac)3+3H2↑;电化学腐蚀,负极:Al-3e==Al3+,正极:O2+2H2O+4e==4OH-
58、(1)保持铁不被腐蚀;
(2)防止空气中的O2进入氧化Fe2+;
(3)开始形成原电池,且[H+]大,反应速度快,随着反应进行,Zn溶解。[H+]减小,反应速率减慢;
(4)使Zn(OH)2溶解而与Fe(OH)3分离;
(5)16%。
59、Al-3e==Al3+ Ag2S+2e==2Ag+S2-
2Al+3Ag2S+6H2O==2Al(OH)3↓+6Ag+2H2S↑
60、(1)Fe-2e==Fe2+ 2H++2e=H2↑;
,使铝溶解,此外HClO的强氧化性也能氧化铝。
54、(1)D; (2)加入CuSO4后,构成Fe-Ag原电池,Fe溶解,减轻,Cu2+在银圈上得电子,沉积在其上,增重。
55、(1)甲=乙=丙;(2)甲=乙<丙;(3)甲>乙>丙;
(4)对于丙,形成Zn-Cu原电池,使反应速率加快。
56、钢铁在通常情况下易发生的是吸氧腐蚀,Na2SO3具有较强的还原性,能与水中溶解的氧反应:2Na2SO3+O2==2Na2SO4防止输水管发生吸氧腐蚀。
57、化学腐蚀,2Al+6CH3COOH==2Al(Ac)3+3H2↑;电化学腐蚀,负极:Al-3e==Al3+,正极:O2+2H2O+4e==4OH-
58、(1)保持铁不被腐蚀;
(2)防止空气中的O2进入氧化Fe2+;
(3)开始形成原电池,且[H+]大,反应速度快,随着反应进行,Zn溶解。[H+]减小,反应速率减慢;
(4)使Zn(OH)2溶解而与Fe(OH)3分离;
(5)16%。
59、Al-3e==Al3+ Ag2S+2e==2Ag+S2-
2Al+3Ag2S+6H2O==2Al(OH)3↓+6Ag+2H2S↑
60、(1)Fe-2e==Fe2+ 2H++2e=H2↑;
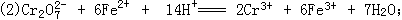 3)H+不断放电,
3)H+不断放电,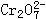 与Fe2+反应中消耗H+,打破了水的电离平衡,使溶液中的[OH-]>[H+];
(4)不能。因为用石墨作电极,阳极产生Cl2,得不到Fe2+缺少还原剂,不能使
与Fe2+反应中消耗H+,打破了水的电离平衡,使溶液中的[OH-]>[H+];
(4)不能。因为用石墨作电极,阳极产生Cl2,得不到Fe2+缺少还原剂,不能使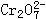 ─→Cr3+─→Cr(OH)3↓而除去。
─→Cr3+─→Cr(OH)3↓而除去。
42、(1)某一元弱酸溶液(A)与二元强酸溶液(B)pH值相等。若将两溶液稀释相同的倍数,pH(A)____pH(B)(填>,=,<)。简述原因________________________。 43、当温度在80℃时,纯水的pH值小于7,其原因是___________________。 44、有一学生在实验室测某溶液的pH值,实验时,其先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。 (1)该生的操作方法是否正确?________________________。 (2)如不正确请说明理由,同时请分析是否一定有误差产生:__________。 (3)若用此法分别测定[H+]相等的H2SO4和H3PO4溶液的pH值,结果会怎样? _______________________。 45、水溶液中经常同时存在着几种离子。是否有这样的情况,即加水将某溶液稀释时,溶液中有的离子浓度变大。若认为有这种情况,请举一例来说明:若认为没有,请通过说理加以解释__________________。 46、取体积相同(0.025L)的两份0.10mol/LNaOH溶液,把其中一份放在空气中一段时间后,溶液的pH值_____(填增大、减小或不变),其原因是________。用已知浓度的硫酸溶液中和上述两份溶液,若中和第一份(在空气中放置一段时间)所耗H2SO4的体积为VA,另一份耗H2SO4体积为VB,则(1)以甲基橙为指示剂时,VA与VB的关系是_________,(2)以酚酞为指示剂时,VA与VB的关系是_______。 47、(1)碳酸钾的水溶液蒸干得到固体物质是_____,原因是___________。 (2)KAL(SO4)2溶液蒸干得到的固体物质是_____,原因是____________。 (3)碳酸氢钡溶液蒸干得到的固体物质是_____,原因是____________。 (4)亚硫酸钠溶液蒸干得到的固体物质是_____,原因是____________。 (5)氯化铝溶液蒸干得到的固体物质是_____,原因是_______________。 (6)盐酸与硫酸各1mol/L的混合酸10mL,加热浓缩至1mL,最后的溶液的浓度为_____,原因是______________________。 48、A、B两种物质都是由氢、氮、氧、钠四种元素中的任意三种元素组成,它们的水溶液分别呈酸性或碱性。在相同温度下的A溶液的pH值大于相同浓度的B溶液的pH值(溶液浓度不小于10-5mol/L),请找出A和B可能有的两种组合,并且要求当这两种组合中的B溶液的pH值相等时, 第一种组合的B溶液中水的电离度小于第二种组合的B溶液中水的最离度。 (1)写出可能有的两种组合中A和B的化学式:第一种组合:A是_________;B是_____________。 第二种组合:A是__________;B是_________。 (2)说明pH值相等时,第一种组合的B溶液中水的电离度比第二种组合的B溶液中水的电离度小的原因:________________________。 (3)在上述的第一种组合中,若A、B的物质的量浓度相同且温度相同,设A溶液中水的电离度是a1,B溶液中水的电离度是a2,那么a1和a2的关系式是______________。 49、25℃时,在0.1mol/L的CH3COOH中滴入甲基橙指示剂溶液呈现红色,表示溶液的pH值范围是__________。然后向此溶液中加入少量CH3COONH4晶体。溶解后溶液的颜色由红变黄色,表示溶液的pH值范围_________,发生这种变化的原因是___________________。 50、正常人体血液的pH值为7.35-7.45,有人根据pH+pOH=14,指出人体血液的pOH值为6.65-6.55.这种看法_____(填“对”或“不对”)。其理由是_________。 51、泡沫灭火剂包括Al2(SO4)3溶液(约1mol/L)、NaHCO3溶液(约1mol/L)及起泡剂。使用时发生的化学反应方程式是_________________,Al2(SO4)3 溶液和NaHCO3溶液的体积比约是_______。若用等体积、等浓度(mol/L)的Na2CO3溶液代替NaHCO3溶液,在使用时喷不出泡沫,这是因为_______;若用固体NaHCO3代替NaHCO3溶液,在使用时喷不出泡沫,这是因为_____泡沫灭火器内的玻璃筒里盛Al2(SO4)3溶液,铁筒里盛NaHCO3溶液,不能把Al2(SO4)3溶液盛在铁筒里的原因是________________________。 52、已知一种pH=3的酸溶液和一种pH=11的碱溶液等体积混合后,溶液的pH值小于7,其原因可能是____________________。 53、在不使用隔膜的情况下,电解食盐水,可制得一种漂白液,漂白液的主要成分是_________,漂白液能否用铝制容器盛装?_____,其原因是_______。 54、如下图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地从烧杯中央滴入CuSO4溶液。
(1) 片刻后观察到的现象是(指悬吊的金属圈)_______________。
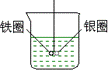 A 铁圈和银圈左右摇摆不定
B 保持平衡状态不变
C 铁圈向下倾斜
D 银圈向下倾斜
(2) 产生上述现象的原因是_____________________。
55、称取三份锌粉,分盛三支试管中,按下列要求另加物质后,塞上导管塞子,定时间测定生成氢气体积。试管甲加入pH=3的盐酸50mL,乙加入pH=3的醋酸50mL,丙加pH=3的醋酸50mL及少量胆矾粉末。若反应终了,生成氢气一样多,且没有剩余的锌,请用>、=、<回答:
(1)开始时反应速率的大小为__________________。
(2)三支试管中参加反应的锌的质量___________________。
(3)反应终了,所需时间是_________________________。
(4)简要说明在反应过程中乙、丙速率不同的理由是__________________。
56、在工业上常用亚硫酸钠除去水中溶解的氧,防止输水管被腐蚀,请简要说明原因______________________。
57、铝制饭盒盛放醋酸一段时间后饭盒被腐蚀,该种腐蚀属_______,反应的化学方程式表示为_______________;若用铝饭盒盛放食盐(含水时)一段时间后,饭盒被腐蚀,这种腐蚀叫做_____________,反应原理是(写离子方程式)_______________。
58、实验室分析白铁(镀锌)样品成分,称取1.00g样品放在烧杯中,加入过量盐酸,然后用玻璃片盖住烧杯,首先观察到大量气体冒出,后来放出气体速率变慢,最后完全反应。接着加入过量的NaOH溶液,过滤分离出灰绿色沉淀,该沉淀在空气中加热至质量不变,最后得到1.20g红色粉末。试回答:(1)白铁镀锌的作用是_________。(2)盖玻璃片的作用是_______。(3)放出气体速率由快变慢的原因是_______。(4)为什么要加入过量NaOH溶液_______。
(5)锌在样品中的百分含量是______________。
59、银器皿日久表面逐渐变黑色,这是由于生成硫化银。有人设计用原电池原理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银不会损失。试回答:在此原电池反应中,负极发生的反应为____________;正极发生的反应为__________________;反应过程中产生臭鸡蛋气味的气体,原电池总反应方程式为_________________________。
60、工业上为了处理含
A 铁圈和银圈左右摇摆不定
B 保持平衡状态不变
C 铁圈向下倾斜
D 银圈向下倾斜
(2) 产生上述现象的原因是_____________________。
55、称取三份锌粉,分盛三支试管中,按下列要求另加物质后,塞上导管塞子,定时间测定生成氢气体积。试管甲加入pH=3的盐酸50mL,乙加入pH=3的醋酸50mL,丙加pH=3的醋酸50mL及少量胆矾粉末。若反应终了,生成氢气一样多,且没有剩余的锌,请用>、=、<回答:
(1)开始时反应速率的大小为__________________。
(2)三支试管中参加反应的锌的质量___________________。
(3)反应终了,所需时间是_________________________。
(4)简要说明在反应过程中乙、丙速率不同的理由是__________________。
56、在工业上常用亚硫酸钠除去水中溶解的氧,防止输水管被腐蚀,请简要说明原因______________________。
57、铝制饭盒盛放醋酸一段时间后饭盒被腐蚀,该种腐蚀属_______,反应的化学方程式表示为_______________;若用铝饭盒盛放食盐(含水时)一段时间后,饭盒被腐蚀,这种腐蚀叫做_____________,反应原理是(写离子方程式)_______________。
58、实验室分析白铁(镀锌)样品成分,称取1.00g样品放在烧杯中,加入过量盐酸,然后用玻璃片盖住烧杯,首先观察到大量气体冒出,后来放出气体速率变慢,最后完全反应。接着加入过量的NaOH溶液,过滤分离出灰绿色沉淀,该沉淀在空气中加热至质量不变,最后得到1.20g红色粉末。试回答:(1)白铁镀锌的作用是_________。(2)盖玻璃片的作用是_______。(3)放出气体速率由快变慢的原因是_______。(4)为什么要加入过量NaOH溶液_______。
(5)锌在样品中的百分含量是______________。
59、银器皿日久表面逐渐变黑色,这是由于生成硫化银。有人设计用原电池原理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银不会损失。试回答:在此原电池反应中,负极发生的反应为____________;正极发生的反应为__________________;反应过程中产生臭鸡蛋气味的气体,原电池总反应方程式为_________________________。
60、工业上为了处理含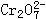 酸性工业废水,按下面的方法处理:往工业水中加入适量NaCl,以铁为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。试回答:
(1)电极反应式:阳极_____________,阴极_____________;
(2)由
酸性工业废水,按下面的方法处理:往工业水中加入适量NaCl,以铁为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。试回答:
(1)电极反应式:阳极_____________,阴极_____________;
(2)由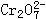 变Cr3+的离子方程式__________________;
(3)工业废水由酸性变碱性原因_____________________;
(4)能否改用石墨电极?原因是什么?______________________。
变Cr3+的离子方程式__________________;
(3)工业废水由酸性变碱性原因_____________________;
(4)能否改用石墨电极?原因是什么?______________________。
附答案
35、合成氨工业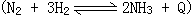 采用高压条件下进行;接触法制硫酸工业
采用高压条件下进行;接触法制硫酸工业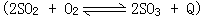 采用常压条件下进行,其理由是______。
36、难溶的银盐中,醋酸银(AgAc)溶解度相对较大。当V1mL,2mol/LNaAc溶液和V2mL,2mol/L AgNO3溶液混合发生反应时,欲使得到AgAc的沉淀量较接近理论值,则V1和V2的关系是_______________。简述理由:__________________。
37、(1)在
采用常压条件下进行,其理由是______。
36、难溶的银盐中,醋酸银(AgAc)溶解度相对较大。当V1mL,2mol/LNaAc溶液和V2mL,2mol/L AgNO3溶液混合发生反应时,欲使得到AgAc的沉淀量较接近理论值,则V1和V2的关系是_______________。简述理由:__________________。
37、(1)在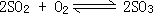 的平衡体系中,加入由18O构成的氧气,当平衡发生移动后,SO2中18O的含量____________(填增加、减少或不变),其原因______________。
(2)CuCl2溶液Z有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:
的平衡体系中,加入由18O构成的氧气,当平衡发生移动后,SO2中18O的含量____________(填增加、减少或不变),其原因______________。
(2)CuCl2溶液Z有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:
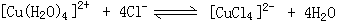 现欲使溶液由黄色变成黄绿色,请写出两种可采用的方法:
①____________________②____________________。
38、在水溶液中橙红色的
现欲使溶液由黄色变成黄绿色,请写出两种可采用的方法:
①____________________②____________________。
38、在水溶液中橙红色的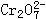 与黄色的
与黄色的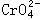 有平衡关系:
有平衡关系:
 。把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
①向上述溶液中加入NaOH溶液,溶液呈________色,因为________。②向已加入NaOH溶液的①中再加入过量稀硫酸,则溶液应是____色,因为_________;③向原溶液中加入硝酸钡溶液(已知BaCrO4为黄色沉淀),则平衡_________,溶液颜色将_____________。
39、在MgCl2溶液中加入氨水,立即产生白色沉淀,待沉淀完全后,将沉淀分装在四支
。把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
①向上述溶液中加入NaOH溶液,溶液呈________色,因为________。②向已加入NaOH溶液的①中再加入过量稀硫酸,则溶液应是____色,因为_________;③向原溶液中加入硝酸钡溶液(已知BaCrO4为黄色沉淀),则平衡_________,溶液颜色将_____________。
39、在MgCl2溶液中加入氨水,立即产生白色沉淀,待沉淀完全后,将沉淀分装在四支
 试管中,往其中分别加入足量的NH4Cl、CH3COONH4、NaHCO3、NH4HCO3的浓溶液,均可使白色沉淀溶解,其原因是______________________。
40、冰醋酸不导电。慢慢加入少量水稀释,溶液导电性逐渐增强;当加入较多量水时溶液导电性减弱,再加入含相等物质的量的NaOH溶液,溶液导电性又增强。试解释以上事实。
41、在某装置中有20mLpH=3的醋酸溶液,逐
试管中,往其中分别加入足量的NH4Cl、CH3COONH4、NaHCO3、NH4HCO3的浓溶液,均可使白色沉淀溶解,其原因是______________________。
40、冰醋酸不导电。慢慢加入少量水稀释,溶液导电性逐渐增强;当加入较多量水时溶液导电性减弱,再加入含相等物质的量的NaOH溶液,溶液导电性又增强。试解释以上事实。
41、在某装置中有20mLpH=3的醋酸溶液,逐
滴加入0.2mol/L氨水,测得溶液的导电性变化
如右图所示,请回答: (1)加入氨水前醋酸的电离度是_____。 (2)溶液导电性变化的原因是_______。
34、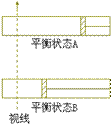 600K时,在容积可变的透明容器内,反应
600K时,在容积可变的透明容器内,反应
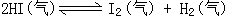 达到平
衡状态A。保持温度不变,将容器的容积
压缩成为原容积的一半,达到平衡状态
B。按右图所示的观察方向,能否看出两
次平衡时容器内气体颜色的深浅变化?并
达到平
衡状态A。保持温度不变,将容器的容积
压缩成为原容积的一半,达到平衡状态
B。按右图所示的观察方向,能否看出两
次平衡时容器内气体颜色的深浅变化?并
请说明理由。__________________。
33、把钢件放入NaNO2和NaOH以一定配比形成的混合溶液中,表面形成蓝色氧 化层(发蓝)对钢件起保护作用。生成氧化物层的反应是: ①3Fe + NaNO2 + 5NaOH == 3Na2FeO2 + NH3 + H2O ②6Na2FeO2 + NaNO2 + 5H2O == 3Na2Fe2O4 + NH3 + 7NaOH ③___Na2FeO2 + ___Na2Fe2O4 + ___H2O == ___Fe3O4 + ___NaOH (1)配平以上第③步反应的化学方程式; (2)升高温度,单位时间内氧化层增厚的原因是______________。 (3)增大NaNO2浓度,氧化层厚度会_______,原因是______,NaOH浓度过大,氧化层厚度会略小,原因是__________________。
32、可逆反应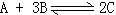 ,在反应过程中C的百分含量C%与温度的关
,在反应过程中C的百分含量C%与温度的关
 系如右图。
(1)该反应是(吸热、放热)___________反应。
(2)温度t<500℃时,C%逐渐增大的原因_____。
(3)温度t>500℃时,C%逐渐减少的原因是_____。
系如右图。
(1)该反应是(吸热、放热)___________反应。
(2)温度t<500℃时,C%逐渐增大的原因_____。
(3)温度t>500℃时,C%逐渐减少的原因是_____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com