
题目列表(包括答案和解析)
1、根据右图实验,填空和回答
问题。 1(1)烧瓶中所发生的主要反应的 化学方程式是______。装置Ⅱ的烧 杯中冷水所起的作用是______。装 置Ⅲ的烧杯中液体的作用是______。 (2)进行此实验时,烧瓶内的橡 皮塞最好用锡箔包住,用橡皮管连 接的两玻璃管口要相互紧靠,这是 因为_____。
(3)装置Ⅲ的烧杯中使用倒置漏斗可防止液体倒吸,试简述其原因。_____。
2、实验室用一般的气体发生装置来制备Cl2,反应物即使在停止加热后反应还会继续一段时间、当要收集多瓶Cl2时,常有较多的Cl2逸散到空气中去,为了避免Cl2的逸散,并对多余的Cl2随时取用,有人设计了如下(甲)装置来制取Cl2。
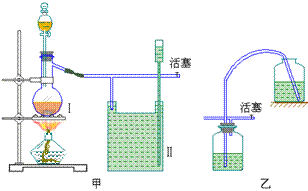 (1)有人设计甲装置是依据了_____(填已学某仪器名称)的原理。甲中装置Ⅱ_____(填能或不能)用乙装置来代替。
(2)甲装置Ⅱ中盛有的液体是_____。该装置可看作是一个_______(填某仪器名称)。简述其主要原理,关闭活塞时,继续产生的Cl2被迫进入Ⅱ,由于Cl2在饱和食盐水中的溶解度较小,大部分Cl2充满液面上空间内,使液体压入漏斗中,保存在瓶Ⅱ的Cl2可以随时开启活塞使用。
3、实验室需要一些纯净的氯化钾,而现有的氯化钾中含有少量的KI、K2SO4和NH4Cl。现按以下方案提纯KCl,并计算不纯氯化钾样品中各组分的质量分数。
(1)有人设计甲装置是依据了_____(填已学某仪器名称)的原理。甲中装置Ⅱ_____(填能或不能)用乙装置来代替。
(2)甲装置Ⅱ中盛有的液体是_____。该装置可看作是一个_______(填某仪器名称)。简述其主要原理,关闭活塞时,继续产生的Cl2被迫进入Ⅱ,由于Cl2在饱和食盐水中的溶解度较小,大部分Cl2充满液面上空间内,使液体压入漏斗中,保存在瓶Ⅱ的Cl2可以随时开启活塞使用。
3、实验室需要一些纯净的氯化钾,而现有的氯化钾中含有少量的KI、K2SO4和NH4Cl。现按以下方案提纯KCl,并计算不纯氯化钾样品中各组分的质量分数。
 (1)给样品加热时,发生反应的化学方程式为_____,应在_____(仪器)中加热。
(2)能否用Ba(NO3)2代替BaCl2,简述理由:_____。
(3)证明
(1)给样品加热时,发生反应的化学方程式为_____,应在_____(仪器)中加热。
(2)能否用Ba(NO3)2代替BaCl2,简述理由:_____。
(3)证明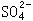 已经沉淀完全的方法是_____。
(4)过滤操作使用的仪器有_____。
(5)通足量Cl2并蒸干、灼烧的目的是_____。
(6)原样品中KI的质量分数的数学表示式为_____。
4、3位同学分别设计了下述三个实验方案,分别验证某无色气体中既含有SO2又含有CO2:
方案一:将无色气体通入酸性KMnO4溶液,KMnO4溶液褪色;反应后再将气体通入澄清石灰水,石灰水变浑浊,即可证明该无色气体中既含SO2,又含CO2。
已经沉淀完全的方法是_____。
(4)过滤操作使用的仪器有_____。
(5)通足量Cl2并蒸干、灼烧的目的是_____。
(6)原样品中KI的质量分数的数学表示式为_____。
4、3位同学分别设计了下述三个实验方案,分别验证某无色气体中既含有SO2又含有CO2:
方案一:将无色气体通入酸性KMnO4溶液,KMnO4溶液褪色;反应后再将气体通入澄清石灰水,石灰水变浑浊,即可证明该无色气体中既含SO2,又含CO2。
方案二:将无色气体通入溴水中,溴水褪色;将反应后的气体通入澄清石灰水,石灰水变浑浊,即可证明原无色气体中既含SO2,又含CO2。
方案三:将无色气体通入品红试液后,再通入酸性 KMnO4 溶液,品红褪色,KMnO4溶液颜色变浅;再将逸出的气体通入澄清石灰水,石灰水变浑浊,则证明原无色气体中既含SO2,又含CO2。
试回答:上述实验方案中,能证明该无色气体中既含有SO2,又含有CO2的方案是__________,简述其理由_____________________。
5、为验证木炭可被浓 H2SO4
氧化成二氧化碳,选用下图仪器(含所盛物质)组装成整套实验装置,试回答下列问题。
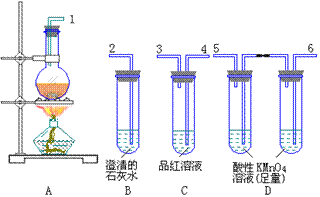 (1)在实验进行中,按气流方向从左到右的顺序,导管口的三处连接应是_____接_____,_____接_____,_____接_____。
(2)试管B、C中应各有什么现象,才能表示已检出了CO2?B中__________,C中_________。
(3)试管D中能否用饱和NaHCO3溶液代替酸性高锰酸钾溶液?说明理由_____。
6、某亚硫酸钠试剂已部分被氧化。为确定其纯度,进行了如下实验:
①称取样品w1g;②将样品溶解;
③在溶液中加入稍过量盐酸酯化的BaCl2溶液;
④过滤、洗涤、干燥沉淀,称其质量为w2g。试回答:
(1)BaCl2要用盐酸酸化的原因_____。
(2)BaCl2溶液要稍过量的原因_____。
(3)判断操作③是否完成的方法是_____。
(4)判断沉淀是否洗净的方法是_____。
(5)Na2SO3纯度的表示为:Na2SO3%=_____。
7、工业上用硫酸亚铁固定制取颜料铁红(Fe2O3),反应原理是
(1)在实验进行中,按气流方向从左到右的顺序,导管口的三处连接应是_____接_____,_____接_____,_____接_____。
(2)试管B、C中应各有什么现象,才能表示已检出了CO2?B中__________,C中_________。
(3)试管D中能否用饱和NaHCO3溶液代替酸性高锰酸钾溶液?说明理由_____。
6、某亚硫酸钠试剂已部分被氧化。为确定其纯度,进行了如下实验:
①称取样品w1g;②将样品溶解;
③在溶液中加入稍过量盐酸酯化的BaCl2溶液;
④过滤、洗涤、干燥沉淀,称其质量为w2g。试回答:
(1)BaCl2要用盐酸酸化的原因_____。
(2)BaCl2溶液要稍过量的原因_____。
(3)判断操作③是否完成的方法是_____。
(4)判断沉淀是否洗净的方法是_____。
(5)Na2SO3纯度的表示为:Na2SO3%=_____。
7、工业上用硫酸亚铁固定制取颜料铁红(Fe2O3),反应原理是
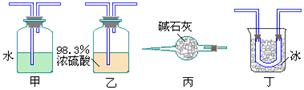
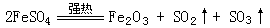 课外活动小组在实验室作这一实验时,为除去混合气体中的SO3得到纯净的SO2气体,应选用下列哪种装置,请将标号及实验原理填入下表:(SO2的沸点为-10.02℃)
课外活动小组在实验室作这一实验时,为除去混合气体中的SO3得到纯净的SO2气体,应选用下列哪种装置,请将标号及实验原理填入下表:(SO2的沸点为-10.02℃)
|
选用装置(标号) |
简答实验原理 |
|
|
|
|
|
|
1、结晶水的存在不能得到甲烷
2、在CH2==CH2中常混有SO2,SO2可被Br2和KMnO4氧化,干扰CH2==CH2与Br2的加成反应及CH2==CH2被KMnO4氧化的实验准确性。
3、(1)NaOH和H2S发生中和反应;现象不明显,酸碱中和反应放热,由于Na2S的水解,未能完全除去H2S。(2)KMnO4氧化H2S;KMnO4也氧化C2H2。(3)CuSO4与H2S反应生成CuS沉淀;现象明显,CuSO4不与C2H2反应。(4)Pb(CH3COO)2
4、HNO3的沸点比硝基苯低,Br2的沸点比溴苯低,易挥发损失,为提高原料利用率,应装回流装置。凡由低沸点原料制高沸点产物时,均应考虑安装回流装置。
5、在溴苯中溶有Br2而呈红褐色,可用稀NaOH溶液洗涤后分液,得到较纯净溴苯。
6、浓H2SO4 浓HNO3 水浴中,
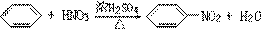 (1)防止温度过高,导致苯的挥发和硝酸的分解。
(2)避免副反应的发生 冷水
7、C2H6、C3H6、C4H6 不存在,依题意X、Y、Z中至少有一种气态烃分子里的氢原子为奇数,而由烷、烯、炔的通式可知不可能。
(1)防止温度过高,导致苯的挥发和硝酸的分解。
(2)避免副反应的发生 冷水
7、C2H6、C3H6、C4H6 不存在,依题意X、Y、Z中至少有一种气态烃分子里的氢原子为奇数,而由烷、烯、炔的通式可知不可能。
 (4)均为加成反应。由于电子云偏向于N原子,使其共轭体系不稳定,且N为负电荷中心,B为正电荷中心。
9、当A为烃时,B为烃的含氧衍生物,在A、B的分子中含有的氢原子数相同,且相差n个碳原子时,必同时相差2n个氧原子。
(4)均为加成反应。由于电子云偏向于N原子,使其共轭体系不稳定,且N为负电荷中心,B为正电荷中心。
9、当A为烃时,B为烃的含氧衍生物,在A、B的分子中含有的氢原子数相同,且相差n个碳原子时,必同时相差2n个氧原子。
 有同分异构体;羧基为1价基,只能在链端,酮基为2价基,只能在链中,这些均不可改变,但羟基的氧原子可连在两碳原子中间,形成新的同分异构体。如:
有同分异构体;羧基为1价基,只能在链端,酮基为2价基,只能在链中,这些均不可改变,但羟基的氧原子可连在两碳原子中间,形成新的同分异构体。如:
 10、(1)(CO)m(H2O)A。 (2)CO (3)m:n=1:1 P为任意值。
10、(1)(CO)m(H2O)A。 (2)CO (3)m:n=1:1 P为任意值。
 (3)无影响;异丙醇发生消去反应同样生成丙烯。
12、(1)CnH2nO。
(2)醇分子含有一个碳碳双键或一个碳环。
(3)A.
(3)无影响;异丙醇发生消去反应同样生成丙烯。
12、(1)CnH2nO。
(2)醇分子含有一个碳碳双键或一个碳环。
(3)A.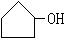 (或其它碳环醇)、
CH2==CHCH2CH2CH2OH(或其它五碳烯醇)。
(或其它碳环醇)、
CH2==CHCH2CH2CH2OH(或其它五碳烯醇)。
 -COOH和酚羟基均具有酸性,可与NaOH生成盐,醇羟基不能与NaOH反应。
-COOH和酚羟基均具有酸性,可与NaOH生成盐,醇羟基不能与NaOH反应。
 酚羟基的酸性极弱,不能跟Na2CO3或NaHCO3反应,只有-COOH跟NaHCO3反应。
酚羟基的酸性极弱,不能跟Na2CO3或NaHCO3反应,只有-COOH跟NaHCO3反应。
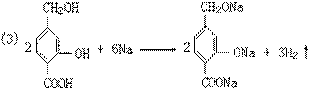 醇羟基、酚羟基、羧基均可与Na发生置换反应,放出氢气。
14、(1)CH3-CH3-OH或CH3-O-CH3
醇羟基、酚羟基、羧基均可与Na发生置换反应,放出氢气。
14、(1)CH3-CH3-OH或CH3-O-CH3
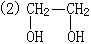 (3)CH3-CH3,该有机物分子中只能含有2个碳原子,6个氢原子,若为烃时只能是乙烷,若为烃的含氧衍生物时可能是乙醇、甲醚、乙二醇。1mol乙醇(甲醚)燃烧耗氧3mol,乙二醇完全燃烧耗氧2.5mol,乙烷完全燃烧耗氧3.5mol。
(3)CH3-CH3,该有机物分子中只能含有2个碳原子,6个氢原子,若为烃时只能是乙烷,若为烃的含氧衍生物时可能是乙醇、甲醚、乙二醇。1mol乙醇(甲醚)燃烧耗氧3mol,乙二醇完全燃烧耗氧2.5mol,乙烷完全燃烧耗氧3.5mol。
 (2)酸性 苯磺酸>亚硫酸>苯酚。较强的酸与较弱的酸的盐反应可得较弱的酸。
(2)酸性 苯磺酸>亚硫酸>苯酚。较强的酸与较弱的酸的盐反应可得较弱的酸。
 (2)使分液漏斗与烧瓶中气压相等,便于盐酸滴下
(3)饱和食盐水,浓硫酸,进入到D的Cl2中将有水蒸气
(4)观察C、E中气泡上升的速度大约相等,表明1体积Cl2经取代后生成1体积HCl。
(5)有黄色,因有FeCl3随HCl的溶解而介入
17、新制Cu(OH)2悬浮在溶液中,与醛分子接触面积大,容易反应。配制已久的Cu(OH)2结合很紧密,与醛分子接触面积小,难以将醛氧化。醛与Cu(OH)2反应生成乙酸,过量的NaOH可中和乙酸,减少副反应发生。
18、因NaOH溶液碱性很强,会使乙酸乙酯水解,重新变成乙酸和乙醇,所以不能用NaOH溶液代替Na2CO3饱和溶液。
19、加入足量NaOH溶液蒸馏,取馏分与Cu(OH)2加热至沸腾,若有红色沉淀则证明甲酸溶液中混有甲醛。
20、(1)-COOH既能和Na反应,又能和Na2CO3反应,如生成H2和CO2的体积相等,则一元羧酸、二元羧酸都可以。
如CnH2n+1COOH、HOOC-(CH2)n-COOH等。
(2)VA>VB,即H2体积大于CO2的体积,说明该有机物不仅有-COOH,而且还有-OH,它们都能和Na反应放出H2,但只有-COOH才能与Na2CO3反应放出CO2,因要求VA=2VB,所以通式可以为HO-(CH2)n-COOH
(3)由以上说明可知,VA<VB,的有机物是没有的。因为在有机物中凡能和
(2)使分液漏斗与烧瓶中气压相等,便于盐酸滴下
(3)饱和食盐水,浓硫酸,进入到D的Cl2中将有水蒸气
(4)观察C、E中气泡上升的速度大约相等,表明1体积Cl2经取代后生成1体积HCl。
(5)有黄色,因有FeCl3随HCl的溶解而介入
17、新制Cu(OH)2悬浮在溶液中,与醛分子接触面积大,容易反应。配制已久的Cu(OH)2结合很紧密,与醛分子接触面积小,难以将醛氧化。醛与Cu(OH)2反应生成乙酸,过量的NaOH可中和乙酸,减少副反应发生。
18、因NaOH溶液碱性很强,会使乙酸乙酯水解,重新变成乙酸和乙醇,所以不能用NaOH溶液代替Na2CO3饱和溶液。
19、加入足量NaOH溶液蒸馏,取馏分与Cu(OH)2加热至沸腾,若有红色沉淀则证明甲酸溶液中混有甲醛。
20、(1)-COOH既能和Na反应,又能和Na2CO3反应,如生成H2和CO2的体积相等,则一元羧酸、二元羧酸都可以。
如CnH2n+1COOH、HOOC-(CH2)n-COOH等。
(2)VA>VB,即H2体积大于CO2的体积,说明该有机物不仅有-COOH,而且还有-OH,它们都能和Na反应放出H2,但只有-COOH才能与Na2CO3反应放出CO2,因要求VA=2VB,所以通式可以为HO-(CH2)n-COOH
(3)由以上说明可知,VA<VB,的有机物是没有的。因为在有机物中凡能和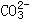 作用生成CO2的官能团一定能和Na反应生成H2。
21、(1)聚甲基丙烯酸甲酯
作用生成CO2的官能团一定能和Na反应生成H2。
21、(1)聚甲基丙烯酸甲酯
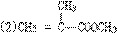 (3)在碱性条件下平衡
(3)在碱性条件下平衡 向右移动,[CN-]增大,反应速率加快。
向右移动,[CN-]增大,反应速率加快。
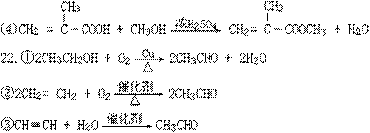 乙烯氧化法即②,流程简单,原料丰富,成本低,且产率高。
23、羧酸脱水为酐,是由一个-COOH中的-H与另一个-COOH中的-OH结合成H2O脱去,HCOOH脱水生成CO,是由-COOH中的-OH和HCO-中的H原子结合成水脱去,且CO不与H2O化合成甲酸。
24、(1)隔绝空气,防止钠被氧化。不可以,因为CCl4密度大,金属钠会浮在上面。
(2)有水存在时会与钠反应,生成NaOH会促使乙酸乙酯水解。冷凝回流,防止空气中水蒸气进入反应体系。
(3)使乙酰乙酸乙酯与乙醇分层。分液漏斗。
(4)除去乙酰乙酸乙酯中的水。这是一个可逆反应,反应到一定程度即达平衡状态,不可能全部转化。
乙烯氧化法即②,流程简单,原料丰富,成本低,且产率高。
23、羧酸脱水为酐,是由一个-COOH中的-H与另一个-COOH中的-OH结合成H2O脱去,HCOOH脱水生成CO,是由-COOH中的-OH和HCO-中的H原子结合成水脱去,且CO不与H2O化合成甲酸。
24、(1)隔绝空气,防止钠被氧化。不可以,因为CCl4密度大,金属钠会浮在上面。
(2)有水存在时会与钠反应,生成NaOH会促使乙酸乙酯水解。冷凝回流,防止空气中水蒸气进入反应体系。
(3)使乙酰乙酸乙酯与乙醇分层。分液漏斗。
(4)除去乙酰乙酸乙酯中的水。这是一个可逆反应,反应到一定程度即达平衡状态,不可能全部转化。
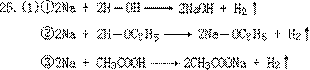 (2)CH3COOH>H-OH>C2H5OH
在含-OH的分子中,-OH中氢氧键的极性越强,与钠发生置换放出氢气的速度越快。
26、(1)CH3-CH==CH2+HCl─→CH3CHClCH3
丙烯可视为乙烯的甲基取代物,由于甲基是斥电子基,使“C=C”的电子云向甲基推斥方向移动,即CH3→CH==CH2,使HCl中带正电荷的氢原子加到带部分负电荷的双键碳原子上,带负电荷的氯原子加到带部分正电荷的碳原子上。
(2)甲酸酸性比乙酸酸性强,因甲基推斥电子减弱了羟基氧氢键的极性。
(3)氯乙酸的酸性比乙酸酸性强,因氯原子具有强烈吸引电子能力,加强了羟基中氧氢键的极性。
27、未加NaOH溶液中和酸,酸溶解了Cu(OH)2。
28、取水解液中至中性,加入新制Cu(OH)2加热,有砖红色沉淀说明开始转化为葡萄糖。取水解液加入碘单质,如不变蓝说明水解完全。
29、随温度升高,酶催化作用显著,加快反应速度;A点后温度使蛋白质受热凝固,失去活性,使反应速度下降。
(2)CH3COOH>H-OH>C2H5OH
在含-OH的分子中,-OH中氢氧键的极性越强,与钠发生置换放出氢气的速度越快。
26、(1)CH3-CH==CH2+HCl─→CH3CHClCH3
丙烯可视为乙烯的甲基取代物,由于甲基是斥电子基,使“C=C”的电子云向甲基推斥方向移动,即CH3→CH==CH2,使HCl中带正电荷的氢原子加到带部分负电荷的双键碳原子上,带负电荷的氯原子加到带部分正电荷的碳原子上。
(2)甲酸酸性比乙酸酸性强,因甲基推斥电子减弱了羟基氧氢键的极性。
(3)氯乙酸的酸性比乙酸酸性强,因氯原子具有强烈吸引电子能力,加强了羟基中氧氢键的极性。
27、未加NaOH溶液中和酸,酸溶解了Cu(OH)2。
28、取水解液中至中性,加入新制Cu(OH)2加热,有砖红色沉淀说明开始转化为葡萄糖。取水解液加入碘单质,如不变蓝说明水解完全。
29、随温度升高,酶催化作用显著,加快反应速度;A点后温度使蛋白质受热凝固,失去活性,使反应速度下降。
29、 酶是蛋白质,具有蛋白质的
特性,酶能催化很多化学反应,右
图中表示为酶参加的反应中,温度
与反应速率的关系,解释曲线变化
酶是蛋白质,具有蛋白质的
特性,酶能催化很多化学反应,右
图中表示为酶参加的反应中,温度
与反应速率的关系,解释曲线变化
的原因_____。
附答案
50、(1) Al3+ +3OH- =Al(OH)3↓
Ba2++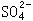 =BaSO4↓
=BaSO4↓
Al(OH)3+OH- =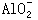 +2H2O
+2H2O
(2)如图
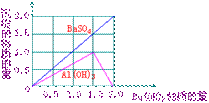
(3)① 1.5aM/N
2KaL(SO4)2+3Ba(OH)2 =2Al(OH)3↓+3BaSO4+K2SO4
② 2aM/N
KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4+2H2O
49、铝和氧化铝都能跟酸、碱作用生成可溶性的、能被人体吸收的铝盐和偏铝酸盐。
48、不一样,因Ac的水解导致水的pH值下降比BAC明显,且 BAC分子有相当数量的OH-离子。
47、(1)加入的NaOH溶液吸收了CO2使罐内气体压强降低,小于大气压而被压瘪。 CO2+2NaOH=Na2CO3+H2O
(2)过量的NaOH溶液与铝制罐反应,产生H2,使罐内压力增大而重新鼓起。
Al2O3+2NaOH =2NaAlO2+H2O;
2Al+2NaOH+H2O =2NaAlO2+3H2↑
(3)内凹而瘪后,不会再重新鼓起。
46、(1)HR,ROH;
(2)若使海水先通过ROH树脂,溶液中会有较多的OH-,这样使海水中的Mg2+转化为Mg(OH)2沉淀;造成堵塞而使海水淡化失败。
45、(1)苏打 中和等量的H+,Na2CO3比NaHCO3的用量少(质量比为 53:84);
(2)小苏打 产生等量的CO2,NaHCO3比 Na2CO3的用量少(质量比为 84:106);
(3)苏打 Na2CO3的水解程度比NaHCO3大,产生等量的OH-需Na2CO3的量比NaHCO3少。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com