
题目列表(包括答案和解析)
16、将一定温度下溶解度小于100g的某物质不饱和溶液分成甲、乙两份。甲份的质量占1/5。已知甲乙两份之一蒸发掉 m克溶剂或另一份溶液中加入Mg溶质完全溶解后都可成为该温度下的饱和溶液。则该物质在此温度下的溶解度为_________。
15、用 Na2SO3 和硫粉在水溶液中加热反应,可制得Na2S2O3。10℃和70℃时,Na2S2O3在100g水中的溶液度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。Na2S2O3在酸性溶液中立即完全分解:
Na2S2O3+2HCl = S↓+SO2↑+H2O+2NaCl
现取15.1Na2SO3溶于80.0mL水中。另取5.00g 1硫粉,用少许乙醇润湿后(以便硫能被水浸润), 加到上述溶液中。用小火加热至微沸,反应约1小时后过滤。滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O晶体。
(1)若加入的硫粉不用乙醇润湿,对反应的影响是______。(填写选项的字母)
A、会降低反应速度 B、需要提高反应温度
C、将增大反应体系析pH值 D、会减少产量
(2)反应1小时后过滤,其目的是 _______________。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是_________。它是由_______________而产生的。如果滤液中该杂质的含量不很低,其检测的方法是_________________________________________。
(4)设Na2SO3跟硫粉完全反应,当将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30mL,该溶液是否达到饱和?试通过计算说明。(70℃时,Na2S2O3饱和溶液的密度为1.17g/cm3)。
(5)若要计算在100℃时将溶液蒸发至体积为30.0mL,再冷却至10℃时所能得到的Na2S2O3·5H2O的质量,你认为 ______(填写一个选项的字母)
A、前面提供的数据已经足够
B、还需要提供100℃时溶液的密度(1.14g/cm3)
C还需要提供结晶后剩余溶液的体积(10.0mL)
(6)根据第(5)小题你的选择(如选A则直接计算,如选B或C则可选用其数据),计算以10℃,30.0mL溶液中结晶出的Na2S2O3·5H2O的质量。
14、已知下列几个反应,判断还原剂中还原性从强到弱的顺序是_____________________
(1)2H2SO3+O2=2H2SO4
(2)2Na2SO3+O2=2Na2SO4
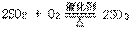 (3)
(3)
13、Na2SO3中有+4 价的硫, 它既有氧化性又有还原性。现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀H2SO4、NaOH 溶液、氨水、稀HNO3。
(1)要证明Na2SO3具有还原性,应选用的试剂有______;现象是_____ _______________,反应的离子方程式是_____________________________。
(2)要证明Na2SO3具有氧化性,应选用的试剂有 _____________; 现象是_____________,反应的离子方程式是________________________。
12、配平下列化学方程式或离子方程式,并回答有关问题。
① ____ Fe3P+____ HNO3 ─ ____ Fe(NO3)3+____ H3PO4 + ___ NO+ ______
② 上述反应中,若有21mol电子转移时,生成是H3PO4是______mol,被还原的硝酸是 _____ g。
③ 上述反应中,当生成1.8mol Fe3+时,放出NO的体积(标准状况下)是 ________ L,消耗的HNO3是 _______ mol。
(2)① ____ P +____ CuSO4+ ____ H2O ─ ____ Cu3P+___ H3PO4 +____ H2SO4
②上述反应中,1molCuSO4氧化P的物质的量为 _______ mol。
(3) _____ KIx + ___ CL2 + ___ H2O ─ ___ KCl + ___HIO3 + ______ ________
若KIx与CL2的系数比为1:8,则x值为 ______ 。
(4) _____ Clm+_____ OH- ─ _____Cl-+_____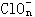 +______H2O
+______H2O
(5) _______ Na2Sx + ______ NaClO + _____ NaOH ─ _______
Na2SO4+ __________ NaCl+______ H2O
若 Na2Sx 在反应中消耗的NaClO和NaOH的物质的量之比为2:1,试比求得的x值写出该多硫化钠的化学式 _______ 。
(6) ____ KClO4 + _____ CrCl2 + ____ H2SO4 + ____H2O ─ _____
H2Cr2O7+_____ Cl2↑+_____ K2SO4
① 氧化剂是 _______ ,还原剂是 _______ ,氧化产物是 ____________;
② 若反应过程中,有0.5molCl2被还原出来,则有 ____molCrCl2发生了反应,并有 _____mol 电子发生了转移。
(7) _____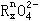 +___________
+___________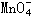 +_____________ H+ =_____RO2
+ ______ Mn2++_________H2O
+_____________ H+ =_____RO2
+ ______ Mn2++_________H2O
上述反应中,若0.2mol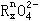 离子参加反应时共转移0.4mol电子。
离子参加反应时共转移0.4mol电子。
① x值= ________ ;
② 参加反应的氢离子的物质的量为 _________ ;
③ 若RO2在常温下为气体,则R属于 _________ 族元素。
11、在一定条件下,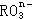 和I-发生的离子方程式如下:
和I-发生的离子方程式如下: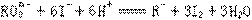
(1)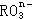 中R元素的化合价是 _________。
中R元素的化合价是 _________。
(2)R元素的原子最外层的电子数是 _________。
10、在 的反应中,每3mol的BrF3中被水还原的BrF3的物质的量是 _______ 氧化产物与还原产物物质的量之比为__________。
的反应中,每3mol的BrF3中被水还原的BrF3的物质的量是 _______ 氧化产物与还原产物物质的量之比为__________。
9、(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液到中性,请写出发生反应的离子方程式:_____________________________________。
(2)在以上中性溶液中,继续滴加 Ba(OH)2溶液, 请写出此反应的离子方程式:_________________________。
8、海水是提取溴的重要资源,从海水中提取溴的方法是:
(1)在 pH=3.5 的海水中通氯气将Br-转变为Br2;
(2)通空气将Br2从海水中吹出,并用Na2CO3溶液吸收;
(3)用硫酸酸化吸收有足量溴的碳酸钠溶液,使单质Br2分离析出。写出上面每个步骤所发生反应的离子方程式。
① _______________________________________;
② _______________________________________;
③ _______________________________________。
7、将0.05mol·L-1Ca(H2PO4)溶液与0.15mol·L-1NaOH溶液等体积混合,搅拌后静置,充分进行反应。请写出反应的离子方程式:_________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com