
题目列表(包括答案和解析)
28、用0.1mol/LNaOH溶液做导电性实验, 然后逐渐滴加入等体积0.1mol/L CH3COOH溶液,随着醋酸溶液的加入,电流计的读数会_______其原因是__________________。
26、A、B两容器极易导热,A容器不变,B容器的活塞可上下滑动,保持内外压强相等,在相同条件下,将等量的NO2 压入容积相同的A、B两容器中进行反应: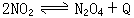 (用大于、小于、等于、增加、减小)回答下列问题:
(用大于、小于、等于、增加、减小)回答下列问题:
(1)反应起始时,两容器中生成N2O4的速率关系是______;
(2)反应达平衡时,两容器中生成N2O4的速率关系是______;
(3)反应达平衡后,NO2转化率大小关系是αA______αB;
(4)反应过程中____容器中反应先达平衡,在均达平衡后,分别向两容器中充入等量的氩气,会造成平衡动的容器是____平衡移动后,NO2 转化率将______;
(5)达平衡时两容器中分子总数nA______nB;
(6)达平衡时两容器中的压强PA______PB。
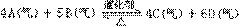 27、在一定温度下,把4
molA气体和5 mol气体通入一个固定容积的密闭容器中,发生以下反应:
当此反应进行到一定程度时,反应混合物就处于化学平衡状态。
现在该容器中,维持温度不变,令a、b、c、d 分别代表初始加入的A、B、C、D的物质的量,如果、取不同的数值,它们必须满足一定关系,才能保证达到平衡时完全相同,请填写下列空白:
27、在一定温度下,把4
molA气体和5 mol气体通入一个固定容积的密闭容器中,发生以下反应:
当此反应进行到一定程度时,反应混合物就处于化学平衡状态。
现在该容器中,维持温度不变,令a、b、c、d 分别代表初始加入的A、B、C、D的物质的量,如果、取不同的数值,它们必须满足一定关系,才能保证达到平衡时完全相同,请填写下列空白:
(1)a =0,b=0时,则c=_____, d=_____。
(2)若a=1,则c=_____,d=_____。
(3)a、b、c 取值必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c)。
24、可逆反应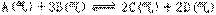 在四种不同情况下的反应速率分别为:①VA=0.15mol/L·S ②VB=0.6mol/L·S ③VC=0.4mol/L·S ④VD=0.45mol/L·S,则该反应在不同条件下的反应速率最快的是______。(填序号)
在四种不同情况下的反应速率分别为:①VA=0.15mol/L·S ②VB=0.6mol/L·S ③VC=0.4mol/L·S ④VD=0.45mol/L·S,则该反应在不同条件下的反应速率最快的是______。(填序号)
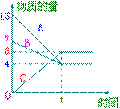 25、某温度时,在VL密闭容器中A、B、C三种物质的物
25、某温度时,在VL密闭容器中A、B、C三种物质的物
质的量随时间的曲线如右图所示。由图中数据分析:
(1)该反应的化学方程式为 __________________;
(2)求时间 t时B的转化率__________________;
(3)反应开始至ts,C的平均反应速率__________________;
23、X、Y、Z三种常见的短周期元素,可以形成、等化合物。已知Y离子和Z的离子有相同的电子层结构,X离子比Y离子多一个电子层。试回答:
(1)X离子的结构简图____________;
(2)写出工业上由XY2制取XY3的化学方程式____________________;
(3)Z2Y对应水化物的碱性比LiOH________;
(4)Z2Y2的电子式为____________,其中含有_______键和________键。Z2Y2溶在水中的化学反应方程式__________________________;
(5)Z2X属于______晶体,它与水反应的离子方程式为:__________________________。
22、AxByCz是由A、B、C三种处于不同短周期的元素组成的化合物。已知:
(1)x、y、z均为正整数,且x+y+z=13。
(2)取0.05mol该化合物与过量的水反应,产生2.4g气体M,同时生成0.05 mol白色胶状沉淀R,且R既能溶于强酸又能溶于强碱。
(3)同温同压下,20mL由B、C两元素组成的M气体,完全燃烧时需40mLO2,燃烧产物为CO2和H2O,通过分析判断可知3种元素分别是A、_________、B______、C______,气体M的化学式是_______,该化合物的化学式是 __________。
21、今有A、B、C、D四种短同期元素,它们的核电荷数依次增大。A与C、B与D分别是同族元素。B、D 两元素的质子数之和是A、C两元素质子数之和的两倍。这四种元素中有一种元素的单质易溶解于CS2溶剂中。则四种元素是:
A_______、 B_______、 C_______、 D________。
写出两种均含四种元素的化合物相互反应放出气体的化学方程式__________________
20、今有A、B、C、D四种元素。其中A元素为1826年法法国青年发现。他在研究海水制盐时,于剩余的副产物苦卤中通入氯气后发现溶液颜色变深。若进一步提取,可得一种红棕色液体,有刺鼻的臭味。B、C、D均为短周期元素。D原子核内的质子数正好等于C原子核内质子数的两倍,而它们最外电子层上电子数的2倍。则四种元素是:
A _______ B_______ C_______ D_______。
写出由上述元素组成的单质或化合物相互作用生成沉淀的二个反应方程式
(1)_________________________________________
(2)_________________________________________
19、在周期表中,同一主族元素化学性质相似,但是会发现有些元素的化学性质和它在周期表中左上方和右下方的另一主族元素性质相似,如锂与镁,铍与铝等 ,这称为对角线规则。请回答下列问题:
(1)锂在空气中燃,除生成 _______ 外,也生成微量的 _________。
(2)铍的最高氧化物的水化物的化学式是 ________ 属 ______化合物,证明这一结论的有关离子方程式是 _________________________________。
(3)若已知反应Be2C+4H2O=2Be(OH)2+CH4↑,则AL4C3遇强碱溶液反应的离子方程式是 _______________________________。
18、向强碱性的热溶液中加入足量硫粉,发生反应生成S2-和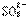 ;生成物继续跟硫粉作用生成
;生成物继续跟硫粉作用生成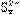 和
和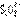 。过滤后除去过量的硫,向滤液中加入一定量的强碱后再通入足量的SO2,SO2跟
。过滤后除去过量的硫,向滤液中加入一定量的强碱后再通入足量的SO2,SO2跟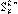 反应也完全转化为
反应也完全转化为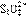 请回答:
请回答:
(1)写出以上各步反应的离子方程式
① ____________________________________,
② ____________________________________,
③ ____________________________________,
④ ____________________________________,
(2)若有amol硫经上述转化后,最终完全变为Na2S2O3,至少需SO2和NaOH的物质的量分别是 ① ____________,② ____________。
(3)若原热碱液中含NaOH 6mol,则上述amol硫的转化过程里生成的 Na2Sx中的X值为_______。
17、常温下,将20.0g14%的NaCl溶液和30.0g24%的NaCl溶液混合,得到密度为1.15g/cm3的混合溶液。
(1)该混合溶液的质量分数是 ______。
(2)该溶液的物质的量浓度是 ______mol/L。
(3)在1000g水中溶解______molNaCl才能使其浓度与上述混合溶液的浓度相等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com