
题目列表(包括答案和解析)
27.某科研小组用高岭土(主要成分是 Al2O3·2SiO2·2H2O 并含少量CaO、Fe2O3)研制新型净水剂(铝的化合物)。其实验步骤如下:将土样和纯碱混合均匀,加热熔融,冷却后用水浸取熔块,过滤,弃去残渣。滤液用盐酸酸化,经过滤,分别得到沉淀和溶液,溶液为净水剂。
(1)写出熔融时主要成分与纯碱的反应方程式(Al2O3与纯碱的反应和SiO2与纯碱的反应类似)
①_________________,②___________________。
(2)最后的沉淀物是_______,生成该沉淀的离子方程式是_______________。
(3)实验室中常用的坩埚有瓷坩埚、氧化铝坩埚和铁坩锅。本实验在熔融土样时应选用_______坩埚。
26.在下图物质的转化关系中,A是一种固体单质,E是一种白色沉淀。

请填写下列空白:
(1)B的化学式_______,B在固态时属于________晶体。
(2)B和a溶液反应的离子方程式是__________________。
(3)A和a溶液的反应的化学方程式是_________________。
25.三硅酸镁被用来治疗胃溃疡,是因为该物质不溶于水,吸附后能中和胃酸,作用持久,把三硅酸镁Mg2Si3O8·nH2O改写成氧化物形式为________,写出它中和胃酸(HCl)的化学方程式________________。
24.矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的。风化作用是指矿物与水和CO2同时作用的过程。如钾长石( KAlSi3O8 )风化生成高岭土[Al2Si2O5(OH)4]的反应为:
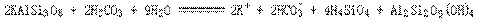
这个反应能够发生的原因是______________________。
23.大气中CO2的增多会引起温室效应,空气中增多的CO2主要来源于_____;自然界中消耗的CO2主要过程是___________;呼吸面具中Na2O2可吸收CO2放出O2,若用超氧化钾(KO2)代替过氧化钠,也可起到同样的作用,这一反应的化学方程式为_______________;若CO2中混有CO,除去的方法是______________;若CO2中混有HCl,要得到纯CO2其方法是______________。
22.古代的“药金”外观与金相似,常误认为是金子。冶炼的方法如下:将碳酸锌、赤铜(Cu2O)、木炭混合加热至800℃得金光闪闪的药金,则药金的主要成分是________,有关化学方程式是_________________,_______________, ________________________。
21.把河沙(主要成分是SiO2)跟镁粉按一定质量比(质量比略大于15:24)混合均匀,装入试管中加热大约1min后发生剧烈反应,生成一种白色固体化合物和一种硅化合物。待生成的混合物冷却后放入盛有稀硫酸的烧杯中,立即产生气泡并伴有轻微爆炸声,这是因为产生的气体是一种能在空气中自燃的气态氢化物。
(1)写出河沙与镁粉反应的化学方程式_____________________。
(2)生成的混合物放入稀硫酸中,产生的气体是_____。(填化学式)。
(3)写出产生“爆炸声”时发生反应的化学方程式_________________。
20.金属M可以在不同条件下发生下列五个反应:M + A → I;M + B → H;M + C → H + F;M + D → H + A;M + E → I + G,其中:
①A、B、C、D在通常状况下都是气体,并知C是CO2;
②上述反应的产物,在不同条件下,还可和有关反应物发生下列反应:
F + B → C, A + G → E;
③I是一种离子化合物,它可以水解产生一种白色沉淀和E。该白色沉淀加热可分解为H和H2O。而E则是分子晶体,其分子中共有10个电子。
根据以上条件判断并写出有关物质的化学式。A_____B_____C_____D_____E____ F_____G_____H_____I_____M_____。
19.将P2O5跟纯HNO3混合,温度控制在30℃以下,结果有N2O5生成,P2O5在此反应中起_________作用,反应式为_____________________。
18.一种氮的无色氧化物,在密闭容器中加热时,其密度逐渐变小,在200℃时,约为原来的一半;继续加热时,容器里物质的密度继续减小,在600℃时,约为200℃时的2/3(容器内的压强始终是1.01×105帕)。当降低温度时,容器内的密度增大,最后仍然得到原来的氮的氧化物。写出上述变化的化学方程式___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com