
题目列表(包括答案和解析)
5、(1)取HNO3酸化的AgNO3溶液与少量混合物的溶液反应,有白色沉淀生成,证明含有氯元素。
(2)另取少量固体混合物与浓H2SO4在铅皿中共热并盖上玻片,玻璃被腐蚀,证明含有氟元素。
4、(1)③、①、④ (2)①、④、⑥、⑤、②
(3)2.使试管内外压强相等 (4)试管与烧杯底接触时温度过高
(5)先称一小烧杯的质量,再将KOH放在烧杯中称取15克KOH,然后加水35毫升,用玻璃搅拌均匀
(6)将溶液倒入烧杯内冷却,即有晶体析出,滤出母液即得KClO3晶体。
3、溴的上层用水封。用食指按住25mL移液管上端,插入溴层中,移开食指,用洗耳球吸液至刻度处,按住上口,取出置于盛40mL蒸馏水的试管中,移开食指。饱和溴的水溶液。水的饱和溴溶液(或溴)红棕色,接近无色。
1、①碘化钾、生石灰
②Cl2 + 2KI == 2KCl + I2 Br2 + 2KI == 2KBr + I2 CaO+H2O==Ca(OH)2
③混合物放在烧杯里,烧杯上方用一个盛有冷水的烧瓶盖上。 加热时碘发生升华,碘的蒸气遇冷凝结在烧瓶底部外测而与杂质分离。
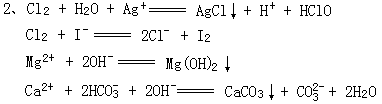
35.有一种工业废水,已知其中含有大量的FeSO4,少量Ag+和Na+以及部分污泥。试设计一个既经济又合理的方法,回收金属银和硫酸亚铁晶体。分步列出实验步骤,并说明每一步骤的目的。
附答案
34.某无色溶液可能由Ba(NO3)2、MgCl2、KOH、KHS、Al2(SO4)3中的一种或几种混合而成,在此溶液中逐滴加入稀NHO3,先产生白色沉淀,而后白色沉淀又会溶解。试回答以下各问:
(1)该无色溶液所含溶质是上述物质中的_______________,其相互反应的离子方程式是_______________________。
(2)滴加稀硝酸产生的白色沉淀是__________,反应的离子方程式是________________。继续滴加稀硝酸使白色沉淀溶解的离子方程式是________。
(3)将上述(1)和(2)得到的两无色溶液混合时,产生的实验现象为_________,离子方程式为________________________。
33.某种混合粉末,可能有Al2(SO4)3、FeSO4、Na2CO3和MgCl2中的一种或几种组成,根据如下实验现象,回答问题:
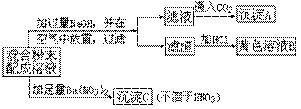
(1)沉淀A是__________;溶液B是__________,沉淀C是___________;
(2)加NaOH后,在空气中放置发生变化的化学方程式是______________;
(3)混合粉末中可能有或没有的物质是________________________;
(4)对可能存在的物质进一步检验的方法是__________________________。
32.将一定质量的镁在空气中充分燃烧,为了分析燃烧产物的成分做如下实验:
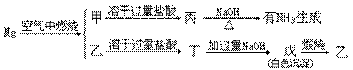
(1)写出下列物质的化学式:
甲_________,乙_________,丙________,丁_________,戊_________。
(2)若将上述实验生成的NHM3通过稀H2SO4,硫酸增重3.4g,戊煅烧到质量不再变化时得到8g固体,则镁燃烧的混合物中甲与乙的物质的最之比是______。
(3)写出甲变化为丙的化学方程式_________________________。
31.一种新的鉴别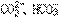 离子的方法要点是:将含有
离子的方法要点是:将含有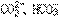 的两种试液分别加到两支试管中,再各加入酚酞指示剂一滴,然后向两支试管中交替地逐滴加入CaCl2溶液。观察到红色先褪去的是
的两种试液分别加到两支试管中,再各加入酚酞指示剂一滴,然后向两支试管中交替地逐滴加入CaCl2溶液。观察到红色先褪去的是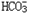 的试液,后褪去的是
的试液,后褪去的是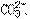 的试液。该方法的原理是____________。
的试液。该方法的原理是____________。
30.某固体混合物可能由KNO3、K2SO4、KI、KCl、NaCl、CuCl2、CaCl2和 Na2CO3中的一种或几种组成。依次进行下列五步实验,观察到的现象记录如下:
(1)混合物加水得无色透明溶液
(2)向上述溶液中滴加BaCl2溶液,有白色溶液生成。将该沉淀滤出,并将滤液分成两份;
(3)上述白色沉淀可完全溶于稀HCl。
(4)将两份滤液中的一份,滴加Cl2水和CCl4振荡静置后,CCl4层无色。
(5)往另一份滤液中滴加AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀HNO3。根据以上实验,可判断出混合物中肯定含有________________;不能判断有________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com