
题目列表(包括答案和解析)
12、25℃时,向VL真空容器内通入nmolSO2和mmolH2S。
(1)若n=2,当m=_____时,反应后容器内气体密度最小;
(2)若2n>m,则反应后氧化产物与还原产物的质量差为_____g;
(3)若5n=m,则反应后氧化产物与还原产物物质量差为48g,则n+m=_____。
11、将xmolNa2SO3和ymolNa2S溶于水中,用硫酸酸化后,下列几种情况中,x与y应满足的条件是:
(1)若只生成S,则x:y_____;
(2)若生成S和SO2,则x:y_____;
(3)若生成S和H2S,则x:y_____。
10、往400mL0.5mol/L的NaOH溶液中通入一定量的H2S气体,然后在低温下蒸发溶液,得到白色固体A。推测固体A所有可能的组成,并求出固体A的质量(xg) 与通入H2S气体体积V的关系,填入下表。
|
编号 |
① |
② |
③ |
④ |
|
A物质可能的组成 |
|
Na2S |
|
NaHS |
|
V(L) |
|
|
|
|
|
x(g) |
|
|
|
|
9、工业上常用漂白粉跟酸反应放出的氯气质量对漂白粉质量分数(x%)来表示漂白粉的优劣。漂白粉与酸的反应为:
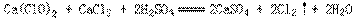
为了测定一瓶漂白粉的x%,进行如下实验。称取漂白粉样品2.00g,加水研磨后,转入250mL容量的瓶内,用水稀释至刻度。摇匀后,取出25.00mL,加入过量的KI溶液和过量的稀硫酸,静置。待漂白粉放出的氯气与KI完全反应后,用0.1mol/L的Na2S2O3标准溶液滴定反应中生成的碘,反应如下:

滴定时用去Na2S2O3溶液20.00mL。试由上述数据计算该漂白粉的x%为_____。
0.014mol/L,氢离子浓度为0.001mol/L,
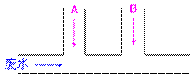
废水排出的速度为10mL/s。为除去废
水中游离氯,并使废水变为中性,有人提出如下试验方案:
(1)A、B处各应分别注入物质的化学式A______,B______,其离子方程式分别是A处___________,B处___________。
(2)A、B两种溶液的流量应分别控制为_______,_______。
8、某项试验排出的废水中含游离态
氯(Cl2)和强酸。游离态氯的浓度为
7、标准状况下的H2和Cl2混合气体aL,经光照反应完成后,所得气体恰能使含bmolNaOH的溶液完全转变为盐。请分别求出下列各种情况下的a、b关系。
(1)若VH2∶VCl2=1∶1,则_____;
(2)VH2∶VCl2>1,则_____;
 (3)VH2∶VCl2<1,则_____。
(3)VH2∶VCl2<1,则_____。
6、某金属7g与足量盐酸反应,可得氢气2.8L(标准状况下),该金属11.2g与21.3g氯气完全反应生成相应的氯化物,则该金属的化学式是_____。
5、现有浓度均为0.2mol/L的NaCl、MgCl2、FeCl3三种溶液各100mL,要使它们所含的Cl-离子全部转化为AgCl沉淀,则需要0.5mol/L的AgNO3溶液的体积比是 ________。
4、某溶液中Cl-、Br-、I-的物质的量之比为1∶2∶3,欲使其比值是3∶2∶1,需通入Cl2的物质的量与原溶液中I-的物质的量之比是_____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com