
题目列表(包括答案和解析)
34、称取金属钠、铝、铁各mg,在室温下分别与VL4mol/L的盐酸充分反应,试判断在下列四种情况下,V值取值范围(用含m的表达式表示)。
(1)铝与盐酸反应放出的氢气最多,则V值取值范围为_____;
(2)钠与盐酸反应放出的氢气最多,则V值取值范围为_____;
(3)铝、铁分别与盐酸反应放出氢气一样多,则V值取值范围为_____;
(4)钠、铝分别与盐酸反应放出氢气一样多,则V值取值范围为_____。
32、向50mLbmol/L的AlCl3溶液中加入50mLamol/L的NaOH溶液。当a≤3b时,生成Al(OH)3沉淀的物质质量为_____mol;当a、b满足______条件时,无沉淀析出;当a、b满足________条件时,先有沉淀析出,后又有沉淀溶解,剩余沉淀的质量为_____。
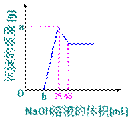 33、准确称取6g铝土矿(含Al2O3、Fe2O3、
33、准确称取6g铝土矿(含Al2O3、Fe2O3、
SiO2)样品,放入盛有100mLH2SO4溶液的烧
杯中。充分反应后过滤,向滤液中加入10mol/L
的NaOH溶液,产生沉淀物质量(g)与加入NaOH
溶液的体积(mL)的关系如右图:
(1)H2SO4溶液的物质的量浓度为_____;
(2)若b=2.75,则铝土矿中各成分质量分数分别为①_____②_____③_____
(3)b值的范围在_____之间,在这个范围内,b值越大,_____的含量越少。
31、现有NaOH和NaHCO3的固体混合物0.2mol,在密闭容器中加热到250℃,让其充分反应后排出气体,冷却,称得残留固体质量为Ag。若混合物中NaOH为xmol(0<x<0.2),问:x为何值时,残留固体为何种物质,并计算A的数值(可以用包含x的式子表示),填表回答:
|
x值 |
残留固体的化学式 |
A值 |
|
(1) |
|
|
|
(2) |
|
|
|
(3) |
|
|
30、将由amolNaHCO3和bmolNaOH组成的固体混合物放在密闭容器中加热至250℃,经充分反应后,排出气体,冷却后,称得残留固体的质量为wg。试写出a、b表示的w的表达式。
(1)当a≤b时,w=_____; (2)当a>b时,w=_____。
29、18.4gNaOH和NaHCO3固体混合物,在密闭容器中加热到约250℃,经充分反应后,排出气体、冷却,称得剩余固体质量为16.6g,则混合物中NaOH的质量分数是_____。
28、将一定量的CH4、O2和Na2O2放入一密闭容器中,用电火花不断引燃混合气体,使其充分反应,反应结束后,容器内压强趋于零(固体物质蒸发不计), 其残余固体溶于水无气体放出。
(1)有关Na2O2反应的化学方程式是____________________。
(2)CH4、O2、Na2O2的物质的量之比是_________。
(3)CH4取0.1mol,向残余固体加足量的盐酸,能放出气体_____mol。
27、将70gNa2O2和Na2O的混合物跟98gH2O充分反应后,所得NaOH溶液的质 量分数为50%。计算原混合物中Na2O2和Na2O的质量为_____g。
26、现有氧化铜和炭粉的混合物共Amol,将它在隔绝空气条件下加热。反应完全后,冷却,得到残留固体。
(1)写出可能发生反应的化学方程式:
①_____________________,②_____________________。
(2)若氧化铜在混合物中物质的量的比值为x(0>x>1),问:x为何值时,残留固体为何种物质?写出残留固体的物质的量与x值之间的关系。将结果填入下表 :
|
x值 |
残留固体的化学式 |
残留固体的物质的量 |
|
|
|
|
25、将炭粉与wg氧气置于密闭容器中,经高温
充分反应后,恢复到初始温度,测得反应前后压
强分别为P0、P,并且P=nP0,加入的碳粉质量
xg与n的变化关系如右图:
(1)写出容器内可能发生的反应的化学方程式①_____②_____。
(2)n的最小值是_____,此时x的取值范围为_____。
(3)n的最大值是_____,此时x的取值范围为_____。
(4)若实验结果测得n值为a,求容器内CO与CO2的体积之比为_____。
(5)如果P是P0的n倍,则x应满足的关系是_____。
(6)如果P0小于P,则x应满足的关系是_____。
23、6.5g某金属跟过量HNO3反应,无气体放出,但向反应所得溶液中加入过量热碱溶液,充分反应后,放出一种气体,其体积为560mL(标准状况),则溶于HNO3的金属是_____,写出其反应的化学方程式_____。
 24、有一组为Ca3(PO4)2·nH3PO4·mH2O的磷酸酸式盐,取该晶体7.56g加热至100℃以上失去全部的结晶水,残余物重7.02g;另取该盐晶体7.56g溶于水,需加4.44g消石灰才能使之全部变为正盐。则:晶体化学式中n、m的值为_____,用酸式盐的形式写出它的化学式为_____。
24、有一组为Ca3(PO4)2·nH3PO4·mH2O的磷酸酸式盐,取该晶体7.56g加热至100℃以上失去全部的结晶水,残余物重7.02g;另取该盐晶体7.56g溶于水,需加4.44g消石灰才能使之全部变为正盐。则:晶体化学式中n、m的值为_____,用酸式盐的形式写出它的化学式为_____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com