
题目列表(包括答案和解析)
23.(本题8分)由稀有气体元素Xe(氙)形成的一种化合物XeO3极不稳定。将适量的XeO3投入30mL0.1mol·L-1含Mn2+的水溶液中,刚好完全反应,放出的唯一气体是Xe单质,其在标准状况下的体积为56mL。则:
(1)有关反应现象:________________________。
(2)若XeO3是分子晶体,写出反应的离子方程式:________________。
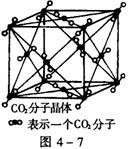
22.(本题8分)(1)图4-7为CO2分子晶体结构的一部分。
观察图形,试说明每个CO2分子周围
有______个与之紧邻等距的CO2分子;
(2)试判断:①CO2、②CS2、③SiO2晶体的沸点由
高到低排列的顺序是______>______>______
(填写相应物质的编号)。
21.(本题10分)配平下列反应方程式,并标出电子转移的方向和数目。
(1)( )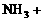 ( )
( )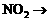 ( )
( )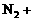 ( )
( )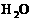
(2)如氨气和二氧化氮共1.5mol,且氧化产物比还原产物的质量多2.8克,
 则:二氧化氮物质的量为__________或__________.
则:二氧化氮物质的量为__________或__________.
20.(本题4分)已知:3Br2+6FeCl2=4FeCl3+2FeBr3,则112mL Cl2(标准状况)通入10mL 1 mol/L的FeBr2液中,发生反应的离子方程式是
19.(本题10分)我国工业上制硫酸的主要含硫原料是
(写名称和化学式;理论上还可以有其它含硫原料),所需的设备为 、
、 。由于水和三氧化硫反应放出大量的热使水汽化而形成酸雾不利于三氧化硫的吸收,因此用浓度为 的浓硫酸吸收。
18.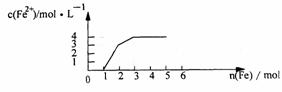 某稀溶液中含有Fe(NO3)3 、 Cu(NO3)2 、HN03,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如右图所示。则稀溶液中Fe(N03)3、Cu(NO3)2、HN03物质的量浓度之比为
某稀溶液中含有Fe(NO3)3 、 Cu(NO3)2 、HN03,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如右图所示。则稀溶液中Fe(N03)3、Cu(NO3)2、HN03物质的量浓度之比为
A.1:1:1 B.1:3:1 C.3:3:8 D、1:1:4
17.现有m1 g KCl饱和溶液,其溶质的质量分数为c1%,对其采取某种措施后析出m g KCl晶体,母液质量为m2 g,其溶质的质量分数为c2%,则下列关系中正确的是
A.c1一定大于c2 B. 原条件下KCl的溶解度小于c1 g
C.m1-m2≤m D、m1c1-100m=m2c2
16.将溶质的质量分数为a%、物质的量浓度为c1mol/L的H2SO4溶液蒸发掉一定量的水,使其溶质的质量分数变为2a%,此时物质的量浓度为c2mol/L.则c1和c2的关系是
A.c2=2c1 B.c2<2c1、 C、c2>2c1 D.c1=2c2
15、某温度下,将CO2和CO按1﹕3的比例混合后,充入一体积不变的容器中,测得压强为P,然后投入足量的过氧化钠,在电火花作用下充分反应至完全,恢复到原来的温度,如不计固体物质的体积,容器中的压强为:
A、P B. 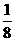 P C、
P C、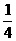 P D、
P D、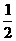 P
P
14.NH3、H2S是极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子。
据上述实例可推出ABn型分子是非极性分子的经验规律是( )
A.分子中不能含有氢原子 B、在ABn分子中A原子没有孤对电子
C.在ABn分子中A的相对原子质量小于B的相对原子质量
D.分子中每个共价键的键长应相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com