
题目列表(包括答案和解析)
23.(8分)已知固体混合物A由NaHCO3、KHCO3、MgCO3、CaCO3四种物质中的两种混合而成。请通过计算和推理回答下列各小题:
(1)取A与足量的盐酸反应:
①若n(A)为定值,生成气体的量即为定值,则A的组成可能有__________种。
②若m(A)为定值,生成气体的量即为定值,则A的可能组成是(填写化学式):
________、________;________、________;________、________。(可以不填满)。
(2)若先将A加热,剩余固体再与足量的盐酸反应,且先后两次产生的气体分别通过足量的澄清石灰水生成的沉淀均为10.0 g,则n(A)=_________mol。
22.(15分)已知A、B、C、D四种短周期元素原子序数依次增大,并依C、D、B、A顺序原子半径逐渐减小。且知A、C同主族,B、D同主族;B、D两原子核外电子数之和为A、C的原子核外电子数之和的两倍;C元素与其它三种元素均能形成离子化合物。试回答下列问题:
(1)写出有关化学用语:①A的元素符号___________;②B的原子结构示意图______________;③C、D形成的化合物的电子式__________________
(2)同时含有上述四种元素的化合物有多种,试写出其中两种的化学式(要求:其中有一种水溶液显中性)____________________________;
(3)X、Y、Z、W四种常见化合物分别由上述四种元素中的三种构成,且各自组成元素均不完全相同。X、Y、W均为离子化合物;Z为共价化合物,且极易分解。在溶液中X、Y、Z两两之间均可反应,其中①Y与Z发生复分解反应可生成W;②X与过量Z发生氧化还原反应时可生成D的单质。试写出上述反应的离子方程式:
①______________________ _②_
(4)a、b、c、d、e五种常见共价化合物分子分别由上述四种元素中的两种构成,其中只有a、c、d为三原子分子,c与e分子中原子核外电子数相同,且知a、e均具有漂白性,b、c两分子以一定比例混合共热可得a、d两种分子,试写出有关化学反应方程式:
①a+e________________ ___(2分)②b+c→a+d___ ___________(2分)
21.(7分)现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,C和D结合生成化合物丁。B、C、D三种元素的单质和甲、乙、丙、丁四种化合物的转化关系如图:
|
|

 B(单质) 甲
B(单质) 甲
|
 乙
C(单质)
乙
C(单质)
又知甲、乙、丙分子含有相同数目的质子。
(1)根据以上条件,可以确定A、B、C、D四种元素中三种,不能被确定的第四种元素是___ __ ___ (填写选项的编号,下同 )( ①A ②B ③C ④D)
写出转化关系图中已确认的反应的化学方程式:__________ __________________,
(2)以下四个补充条件中的任何一个都可以进一步确定第四种元素,其中一个条件推断出的第四种元素与其余三个条件推断出的第四种元素不同,这个条件是__ _____(填序号)
依据该条件推断,第四种元素是_____________(填元素符号)。
①化合物甲与丙、乙与丙均能够发生反应
②化合物甲、乙、丙都是无色物质,其中只有甲有刺激性气味
③通常情况下乙和丁不发生反应,若将乙、丁、单质C混合,立即发生化合反应。
④单质C和化合物丁不能共存。
(3)依据该(2)小题中的第③个补充条件推断出第四种元素。且已知丙和丁在一定条件下能发生化学反应。试写出此化学反应方程式:________________________________
20、(10分)工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:
NH3+CO2+H2O=NH4HCO3……………………………………①
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl………………②
将所得碳酸氢钠晶体加热分解后即可得到纯碱。请回答:
⑴ 业所制纯碱中常含有少量的氯化钠杂质,其原因 ,
(2)现有甲、乙、丙三个小组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下。
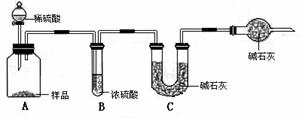
甲组:取10.00g样品,利用下图所示装置,测出反应后装置C中碱石灰的增重为3.52g。
乙组:取10.00g样品,配成1000mL溶液,用碱式滴定管量取25.00mL放入锥形瓶中,加入甲基橙作指示剂,用0.150mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+2HCl=2NaCl+H2O+CO2↑)。完成三次平行实验后,消耗盐酸体积的平均值为30.00mL。
丙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物冷却至室温后称量得固体质量为11.03g。
请分析、计算后填表:
|
分析与 计算 分组 |
计算样品中碳酸钠 的质量分数 |
对实验结果 的评价 |
实验失败的主要原因 及对结果的影响 |
|
甲组 |
|
失败 |
|
|
乙组 |
|
成功 |
/ |
|
丙组 |
|
成功 |
/ |
19.(6分)下列有关实验的叙述,正确的是(填序号) 。
A. 用胶头滴管向试管中滴加液体,滴管一定不能伸入到试管中
B.用渗析法分离淀粉中混有的NaCl杂质
C.无法用分液漏斗将甘油和水的混合液体分离
D. 用酸式滴定管量取20.00mL高锰酸钾溶液
E.用浓氨水洗涤做过银镜反应的试管
F.为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比
G.浓硫酸不小心沾到皮肤上,立刻用稀NaOH溶液洗涤
H.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
J.在氢氧化铁胶体中加入少量硫酸会产生沉淀
K.用结晶法可以除去硝酸钾中混有的少量氯化钠
18.有4.8g CuO、Fe2O3混合物与充足的CO于加热条件充分反应,反应后全部气体用0.6mol·L-1 Ba(OH)2溶液100mL处理,有白色沉淀生成。又知反应后,气体质量为3.52g,下列有关叙述中正却的是
A.原混合物中CuO与Fe2O3物质的量的比为l:l
B.生成的CO2已被Ba(OH)2溶液完全吸收、Ba2+沉淀完全
C.在吸收CO2后的Ba(OH)2溶液中可能有Ba(HCO3)2
D.原混合物中CuO与Fe2O3的质量比为2:1
班级 姓名 学号 得分
第Ⅰ卷(选择题 共54分)
第二卷 (非选择题共46分)
17.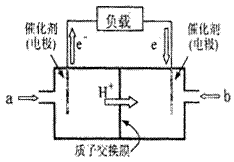 右图是2004年批量生产的笔记本电脑所用甲醇燃料电池的结 构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH30H+302→2C02+4H20。下列说法正确的是
右图是2004年批量生产的笔记本电脑所用甲醇燃料电池的结 构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH30H+302→2C02+4H20。下列说法正确的是
A.左电极为电池的负极,a处通入的物质是甲醇
B.右电极为电池的负极,b处通入的物质是空气
C.负极反应式为:CH30H+H20-6e-→CO2+6H+
D.正极反应式为:02+2H20+4e-→40H-
16.有Na2CO3,AgNO3,BaCl2,HCl及NH4NO35瓶无标签溶液,为鉴别它们,取4支试管分别装入-种溶液,再向上述4支试管中加入少许剩下的一种溶液,下列叙述错误的是A.若3支试管出现沉淀时,则后加入的是AgNO3溶液 B.全部没有明显现象时,则后加的是NH4NO3溶液 C.1支试管出现气体,2支试管出现沉淀时,则后加入的是HCl溶液 D.若仅有2支试管出现沉淀时,则后加入的是BaCl2溶液
15.已知把SO2气体通入BaCl2溶液中无沉淀生成,现把下列物质加入或通入溶液中,能出现沉淀的是⑴N2⑵NO2⑶Cl2⑷H2O2⑸H2S⑹NH3⑺SO3⑻KMnO4⑼HCl⑽Na2O2⑾CO2⑿AgNO3
A. 只有⑴⑵⑶⑸⑺⑼ B、只有⑵⑶⑷⑸⑹⑺⑻⑽⑿
C、 只有⑵⑸⑺⑼⑽⑾ D、只有⑵⑶⑸⑺⑼⑾
14.某溶液中含HCO3-、SO32-、CO32-、CH3COO-等四种阴离子,若向其中加入足量Na2O2后(设溶液体积不变),溶液中上述离子浓度基本保持不变的是
A.SO32- B.CH3COO- C.CO32- D.HCO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com