
题目列表(包括答案和解析)
4. 下列对熔、沸点变化规律叙述正确的是( )
(A) 同主族元素的单质,熔点都随原子序数的增加而升高。
(B) 卤化氢的沸点随 原子序数的增大而升高。
(C) 烷烃沸点随分子中的碳原子数增多而升高;当分子中碳原子相等时,支链越少,
其沸点越高。
(D) 低级饱和脂肪卤代烃的沸点随分子中碳原子数增多而降低。
3. 下列八种工业生产,可直接用到石灰石的是( )
① 炼铁 ② 炼钢 ③ 制硅酸盐水泥 ④ 制普通玻璃
⑤ 制漂白粉 ⑥ 制电石 ⑦ 制波尔多液 ⑧ 制过磷酸钙肥料
(A) ①②③④ (B) ①③④⑥
(C) ①③④⑤ (D) ②③④⑧
2. 下列微粒的空间结构呈正四面体,但键角不是109 度28分的是( )
(A) 白磷P4 (B) 四氯化碳CCl4
(C) 铵根离子 NH (D) 磷化氢PH3
(D) 磷化氢PH3
每小题只有一个选项符合题意。
可能用到的原子量:
H 1 He 4 C12 N 14 O 16 Na 23
Mg24 Al 27 S32 Cl35.5 Zn 65
1. 工业上制取镁粉的方法是将镁的蒸气进行冷却,其中下列最适宜的方法是( )
(A) 在氮气的容器内冷却
(B) 在水中冷却
(C) 在氢气中冷却
(D) 在二氧化碳气体里冷却
有A、B两种溶液,A是把蒙有10.2克氧化铝的铝条放入1升1.5摩/升热NaOH溶液里,过会儿取出铝条,溶液增重12.6克。B是把蒙有氧化铝的铝条放入1升0.9摩/升的硫酸溶液,过会儿取出铝条,溶液增重25.2克。假设A、B两溶液最后的体积仍为1升。
回答下列问题:
A溶液中的溶质是什么?其物质的量的浓度是多少?
6. 某液态有机物A6.2 克与足量镁粉反应,生成2.24 升H2(标准状态下),A与Na2CO3溶液不反应;在同温同压下测得A气体的密度为CO2气体密度的1.41倍。A分子内脱水可得B,A分子间脱水可得C或D。A氧化得E,E再氧化得F。A与F脱水可得G或H。
(1) 推断、写出结构简式:A______________C______________D_______________。
答:
(2) 写出A与F分子间脱水的化学方程式.
答:
 7.
化合物A,学名为邻羟基苯甲酸,俗名水杨酸,其结构简式如下图所示:
7.
化合物A,学名为邻羟基苯甲酸,俗名水杨酸,其结构简式如下图所示:
(1) 将A跟哪种物质的溶液反应可得到一种钠盐,
其化学式为C7H5O3Na?( )
(A) NaOH (B) Na2S
(C) NaHCO3 (D) NaCL
(2)水杨酸的同分异构体中属于酚类,但是不属于酯类、也不属于羧酸类的化合物必定含
有_____基。 ( )
(A) 羟基 (B) 羧基
(C) 醛基 (D) 酚基
5. 在298K时,向V 升真空容器内通入N 摩SO2和M 摩H2S。
(1) 若N = 2 时,则当M 〉( )时,反应后容器内气体的密度最小。
(2) 若2N 〉M ,则反应后氧化产物与还原产物的质量差为( )克。
(3) 若5N = M ,且反应后氧化产物与还原产物的质量之和为48克,则N+M=( ).
3. 将自然界的矿物胆矾(CuSO4·5H2O)溶于水中,若遇到黄铁矿(FeS2),就会发生反应,生成辉铜矿(Cu2S)、硫酸亚铁和硫酸。在有些矿区见到的具有强酸性、强腐蚀性的地下水,俗称“黑水”,就是经过这种反应产生的。
14CuSO4 + 5Fe2S + 12H2O = 7Cu2S + 5FeSO4 + 12H2SO4.反应中,
被氧化的硫原子与被还原的硫原子的物质的量之比为( )。
 4.
根据下列图示,回答问题。
4.
根据下列图示,回答问题。
(1).原两种黑色粉末的名称是(碳)和(二氧化锰);
判断对错:( )
W 盐的化学式为( ALCL3 )。
判断对错:( )
(2). X 与Mg 的反应的化学方程式为: CO2 + 2Mg = 2MgO + C.
判断对错:( )
(3). Z 溶液呈酸性的主要原因是NaHSO4 = Na + H
+ H + SO
+ SO .
.
判断对错: ( )
|
1. 如图所示,在支管锥形瓶A中充满等体积的H2S和NO气体;在分液漏斗B中盛有淀粉碘 化钾溶液;在锥形瓶的支管处用弹簧夹b夹紧,并充满O2的气球C。根据实验,填写:
|
(1).打开分液漏斗的活塞a,将漏斗中的溶液缓慢的流入A中,
发生的变化是:( H2S 气体溶于KI溶液中 )。
请判断:( )
(2).松开弹簧夹b,气球C逐渐_________,
锥形瓶A中的气体 颜色立即变成__________. ( )
(A)增大 棕色 (B)缩小 红色
(C)缩小 棕色 (D)增大 红色
(3).锥形瓶A中的溶液开始变混浊,这是因为______.
(用化学方程式表示)。 ( )
(A)2NO + O2 = 2NO2 (B) H2S + 2NO2 = 2HNO3 + S
(C)2KI + 2NO2 = 2KNO3 + I2 (D)以上都不对。
(4).锥形瓶A中的溶液开始变混浊,在溶液中变混浊的同时,
溶液出现浅蓝色,这是因为( )
(A)2NO + O2 = 2NO2 (B)H2S + 2NO2 = 2HNO3 + S
(C)2KI + 2NO2 = 2KNO3 + I2 (D)以上都不对。
2. 在实验室中制取少量乙酸乙酯的主要步骤如下:
① 把2毫升乙醇、1毫升浓硫酸装入反应的试管中,再加入2毫升10% 的醋酸。
② 在收集试管中,装入饱和的NaOH 溶液,组装好全部装置。
③ 将反应试管加强热,保持剧烈沸腾。
④ 倒出收集试管中的上层液体,即得到产品乙酸乙酯。
指出以上①-④步骤中的主要错误,并回答有关问题:
错误处:
① ________________________________________________________________________,
②________________________________________________________________________,
③________________________________________________________________________,
④________________________________________________________________________,
问题:
(1).步骤③操作的作用是(应小心加热,使酯化反应充分进行,并把乙酸乙酯蒸出)。
判断对错:( )
(2).收集试管中的导管为什么不能插入溶液中?
[答]:
(3).乙酸乙酯的主要用途是_________________,___________________。
25. 将金属镁、铝、铁的单质分别投入到质量相等、浓度相同的稀硫酸中,待反应结束后,
各溶液的质量仍相等,则投入的镁、铝、铁的质量比为( )
(A) :
: 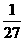 :
:  (B)
(B) 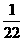 :
:  :
: 
(C)  :
:  :
:  (D)
(D)  :
:  :
: 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com