
题目列表(包括答案和解析)
1.某微粒用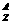 R
R 表示,下列关于该微粒的叙述正确的是( )
表示,下列关于该微粒的叙述正确的是( )
A、所含质子数=A―n B、所含的中子数=A―Z
C、所含的电子数=Z+n D、质量数=Z+A
26.将50mL由pH=1的硫酸和盐酸组成的混合溶液与50mL Ba(OH)2 溶液混合,充分反应后过滤,得0.466g 沉淀,溶液(100mL)中OH-离子浓度为0.1 mol·L-1。求:
(1)原混合液中SO42-、Cl-的物质的量。
(2)Ba(OH)2溶液的物质的量浓度。
25.过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用.它与二氧化碳反应的化学方程式为: 2Na2O2 + 2CO2=2Na2CO3 + O2 。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95克过氧化钠样品为原料,制取O2,设计出如下实验装置:
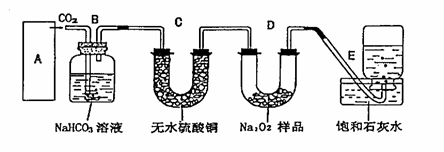
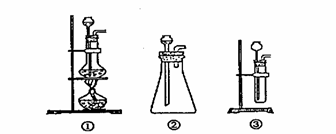 (1)A中制取CO2 的装置,应从下列图①、②、③中选哪个图:
(1)A中制取CO2 的装置,应从下列图①、②、③中选哪个图:
B装置的作用是吸收A装置中产生的盐酸酸雾,C装置内可能出现什么现象?
。为了检验E中收集到的气体,在取出集气瓶后,用 的木条伸入集气瓶内,木条会出现 。
(2)若E中石灰水出现轻微白色浑浊,请说明原因: 。
(3)当D中的1.95克过氧化钠样品接近反应完毕时,你预测E装置内有何现象?
。
(4)反应完毕时,若测得E中的集气瓶收集到的气体为250毫升,又知氧气的密度为1.43克/升,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值 (大或小),相差约 毫升(取整数值,所用数据均在标准状况下测定),这是由于
。
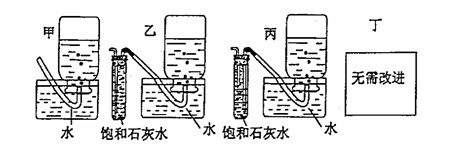 (5)你认为上述A---E的实验装置中,E部分是否安全、合理? ;E是否需要改为下列四项中的哪一项:
。(用甲、乙、丙、丁回答)
(5)你认为上述A---E的实验装置中,E部分是否安全、合理? ;E是否需要改为下列四项中的哪一项:
。(用甲、乙、丙、丁回答)
24.(6分)把温度为13℃,浓度为1.0 mol·L-1的盐酸和1.1mol·L-1的碱溶液各50mL混合[溶液密度均为1g/mL,生成溶液的比热容c=4.184J/(g·℃)],轻轻搅动。测得酸碱混合液的温度变化数据如下:
|
反应物 |
起始温度t1/℃ |
终了温度t2/℃ |
中和热 |
|
HCl+NaOH |
13 |
19.8 |
△H1 |
|
HCl+NH3·H2O |
13 |
19.3 |
△H2 |
(1)试计算上述两组实验测出的中和热:△H1=___________;△H2=___________。
(2)实验中碱液过量的目的是___________________________________________。
(3)两组实验结果差异的原因是__________________________________________。
22.(6分).某化学反应的反应物和产物如下:
KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
(1)该反应的氧化剂是_____________;
(2)如果该反应方程式中I2和KIO3的系数都是5,则KMnO4的系数是____,完成方程式并标出电子的转移方向和数目
KMnO4+ KI+ H2SO4 →
23(9)某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO2-、SO32-、SO42-。现取该溶液进行有关实验,实验结果如下所示:
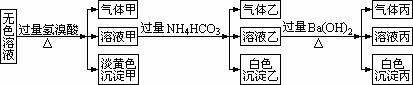
(1)沉淀甲是______,生成沉淀甲的离子方程式为_____________________。
(2)沉淀乙是______,由溶液甲生成沉淀乙的离子方程式为_____________。
(3)沉淀丙是______,用化学实验来确定其成分,其方法是____________。
(4)气体甲的成分有哪几种可能?答:____________________________________。
(5)综合上述信息,可以肯定存在的离子 __________________________________。
21.写出下列离子方程式:(6分)
(1)氢氧化钠溶液中加入少量的Ca(HCO3)2溶液
(2)将过量的二氧化碳气体通入到偏铝酸钠溶液中
(3)将少量的明矾溶液滴加到氢氧化钾溶液中
19.向某盛有7.8gNa2O2的密闭容器中(无空气)通入4.48LNO2(标准状况),然后注入200mL水,充分反应后,容器中所含物质有
A.NaNO2 NO H2O B.NaNO3 NaOH O2 H2O
C.NaNO3 H2O
D.NaNO3
HNO3
O2 H2O
20.将23克金属钠放入足量mg水中,再将24克金属镁放入足量m克稀盐酸中。反应后所得溶液的质量分别为 克和
克和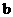 克。那么,
克。那么, 和
和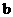 两数值的关系应是
两数值的关系应是
A.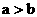 B.
B.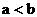 C.
C.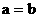 D.无法确定
D.无法确定
将选择题的答案填入下表
第II卷(50分)
18.下列各组中的两种物质作用时,反应条件(温度、反应物用量)改变,不会引起产物种类改变的是
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.C 和O2
17.一定温度下,Wg下列物质在足量氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重Wg,符合此要求的是
(1)H2 (2)CO (3)CO和H2 (4)HCOOCH3 (5)HOOC-COOH
A.全部 B.仅(4)(5) C.仅(1)(2)(3) D.除(5)以外
16.某种干燥粉末混合物可能由Na2O、Na2CO3、、Na2O2、NaCl、NaHCO3中的两种或几种组成(假设固体混合时不反应)。若将其先与足量盐酸反应则逸出气体a,当a缓慢通过足量的NaOH溶液时气体体积缩小(同温、同压),但仍有剩余。另取原混合物在空气中加热至气体不再发生,发现剩余固体的质量增加,则对原混合物的叙述正确的是
A.一定含有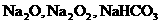 B.一定含有
B.一定含有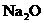 和NaCl
和NaCl
C.不含有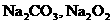 D.不含有
D.不含有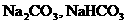
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com