
题目列表(包括答案和解析)
5.下列有关碱金属铷的叙述中,正确的是 ( )
A.灼烧氯化铷时,火焰没有特殊颜色
B.硝酸铷是离子化合物,易溶于水
C.在钠、钾、铷三种单质中,铷的熔点最高
D.氢氧化铷是一种弱碱
4.在一定温度和压强下,阿伏加德罗定律成立的根本原因是 ( )
A.气体所占体积的大小只随气体分子数的多少而变化
B.不同种气体分子的大小几乎相等
C.不同种气体分子间的平均距离几乎相等
D.气体分子间的平均距离与分子本身的大小成正比
3.下列物质的水溶液能导电,但属于非电解质的是 ( )
A.CH3COOH B.Cl2 C.NH4HCO3 D.SO2
2.NH2Cl是一种强力杀菌剂,它加入水中则发生水解反应,其产物有 ( )
①NH2Cl ②HCl ③NH2OH ④NH3 ⑤HClO
A.②③ B.①② C.②④ D.④⑤
1.下列有关化学反应热的说法中,不正确的是 ( )
①放热的反应发生时不必加热
②化学反应一定伴随有能量变化
③一般地,吸热反应需要加热后才能发生
④化学反应热效应数值与参加反应物质的多少有关
A.①② B.②③ C.①③ D.②④
23、(6分)对于可逆反应2A(g)+3B(g) xC(g)+D(g),已知A和B的起始浓度分别为5mol·L-1和3mol·L-1,反应由开始到平衡时间是2min,C的反应速率为0.5 mol·L-1·min-1,平衡时D的浓度为0.5 mol·L-1,回答
(1)x=
(2)B的平衡浓度为
(3)A的转化率为
22、(8分)草酸晶体的组成可表示为H2C2O4·xH2O,为了测定x值,进行下述实验①称取Wg草酸晶体配制100.00mL水溶液 ②取25.00mL所配的草酸溶液置于锥形瓶中,加适量稀H2SO4后,用浓度为a
mol/L的KMnO4溶液滴定,所发生的反应为:KMnO4+H2C2O4+H2SO4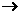 K2SO4+CO2
K2SO4+CO2 +MnSO4+H2O
+MnSO4+H2O
(1)实验②滴定时,KMnO4溶液应装在 滴定管中。
(2)若滴定过程中,读数时,滴定前仰视,滴定后俯视,则所测得的x值 (偏大、偏小、无影响)
(3)若滴定过程中,共用去a mol·L-1KMnO4溶液VmL,所配制的草酸溶液的物质的量浓度为 。由此可计算出草酸晶体结晶水的x值为 。
21、(6分)有一学生在实验室测某溶液pH,实验时他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测
(1)该学生的操作是 (填“正确”或“错误”)
(2)如不正确请说明理由,同时请分析是否一定有误差,
。
(3)若用此法分别测定CH+相等的盐酸和醋酸溶液的pH,误差较大的是 。
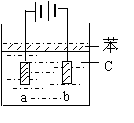
20、(8分)由于Fe(OH)2极易被氧化,用亚铁盐溶液与烧碱溶液反应很难
得到白色纯净的Fe(OH)2沉淀,但用如图所示的电解装置可得纯净
Fe(OH)2沉淀,电极材料分别为石墨和铁。
(1)a电极材料是 ,电极反应式是 。
(2)电解液C可以是 (填编号)
A、纯水 B、NaCl溶液 C、NaOH溶液 D、CuCl2溶液
(3)若C为Na2SO4溶液,电解一段时间看到白色Fe(OH)2沉淀后,再反接电源进行电解,电极上看到气泡时,C中出现的明显现象是 。
19、(12分)两个密闭容器A和B,A容器有一个可移动的活塞使容器保持恒压,B容器保持恒容,起始时向这两容器中分别充入等量的体积比1:3的N2和H2的混合气体,并使A和B的容积相等(如图),恒温下N2(g)+3H2(g) 2NH3(g)
 (1)达平衡的时间,A容器比B容器 (长、短、相等),
(1)达平衡的时间,A容器比B容器 (长、短、相等),
 A容器中N2的转化率比B容器中N2的转化率 (高、低、相等)
A容器中N2的转化率比B容器中N2的转化率 (高、低、相等)
(2)达到(1)平衡后,若向两容器中通入数量不多的等量Ar,
A容器中化学平衡向 (正、逆、不)移动,B容器中化学平
衡向 (正、逆、不)移动。
 (3)达到(1)平衡后,若再向容器中通入等量的体积比为1:3的N2和H2的混合气体,达到新的平衡时,A容器中NH3的体积分数 (增大、减小、不变),B容器中NH3的体积分数 (增大、减小、不变)
(3)达到(1)平衡后,若再向容器中通入等量的体积比为1:3的N2和H2的混合气体,达到新的平衡时,A容器中NH3的体积分数 (增大、减小、不变),B容器中NH3的体积分数 (增大、减小、不变)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com