
题目列表(包括答案和解析)
2、氯气的化学性质:
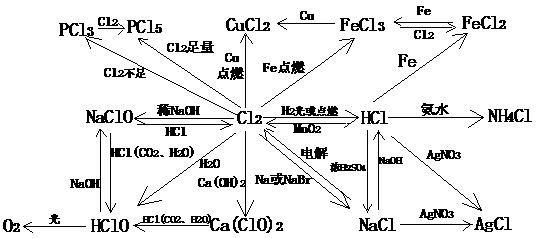
l 氯气能将金属氧化到最高价态;
l 铜在氯气中燃烧产生棕黄色烟,加水后溶液呈蓝绿色;
l 氢气和氯气反应产生苍白色火焰,光照氢气和氯气混合气发生爆炸;
l 2Cl2+2Ca(OH)2 == CaCl2 + Ca(ClO)2 + 2H2O--工业生产漂白粉的原理;
漂白粉的主要成分:CaCl2 、 Ca(ClO)2 ;有效成分: Ca(ClO)2
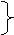 漂白原理:CO2 +H2O+
Ca(ClO)2== CaCO3+2HClO
漂白原理:CO2 +H2O+
Ca(ClO)2== CaCO3+2HClO
漂白粉失效:2HClO = 2HCl +O2↑
1、 氯气的物理性质:黄绿色――鉴别时切入点
有刺激性气味、有毒――注意闻味方法,防毒方法
易液化、能溶于水、密度大于空气――如何收集?
3、 HClO的性质(强氧化性、不稳定性、弱酸性)的证明及漂白粉制取原理、有效成分,使用原理。
基本知识:
2、 掌握氯气的制法及制备装置的特点,区别液氯、新制氯水、久置氯水的成分;
1、 掌握氯气的分子结构物理性质和化学性质;
26.(13分)在标准状况下进行甲、乙、丙三组实验,三组各取30mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量(mg) |
255 |
385 |
459 |
|
生成气体体积(mL) |
280 |
336 |
336 |
(1)甲组实验中,盐酸________(填“过量”、“适量”或“不足量”),理由是______________________;乙组实验中,盐酸_________(填“过量”、“适量”或“不足量”),理由是________________________________ _ 。要算出盐酸的物质的量浓度,题中可作计算依据的数据是________________,求得的盐酸的物质的量浓度为____________。
(2)求合金中Mg、Al的物质的量之比,题中可作计算依据的数据是______________ ,求得的Mg、Al物质的量之比为____________。
(3)在丙组实验之后,向容器中再加入上述同等浓度的盐酸多少毫升,才能使剩余合金恰好完全溶解(写出计算过程)。
25.(11分)实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:
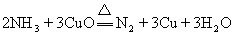
试回答:(1)如果选用测定反应物CuO和生成物H2O的质量(mCuo、
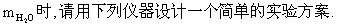
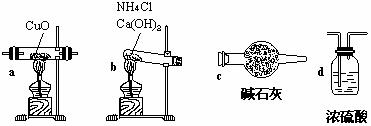
①仪器连接的顺序(用字母编号表示,仪器可重复使用)( ) 接 ( )接( ) 接( )接( ) ;
d中浓硫酸的作用是 ;
实验完毕时观察到a中的现象是 ;
②列出计算Cu的相对原子质量的表达式 。
③下列情况将使测定结果偏大的是 .(以下选择填空不限1个正确答案,均用字母编号填写)
(a)CuO未全部还原为Cu (b)CuO受潮 (c)CuO中混有Cu
(2)如果仍采用上述仪器装置,其他方案可选用测定的物理量有

24. (8分)有三种不同质量比的氧化铜与炭粉的混合物样品①、②、③。甲、乙、丙三同学各取一种样品,加强热充分反应,测定各样品中氧化铜的量。
(1)甲取样品①强热,若所得固体为金属铜,将其置于足量的稀硝酸中微热,产生1.12L气体(标准状况),则样品①中氧化铜的质量为________g。
(2)乙取样品②ag强热,生成的气体不能使澄清的石灰水变浑浊。再将反应后的固体与足量的稀硝酸微热,充分反应后,有bg固体剩余,该剩余固体的化学式为________。样品②中氧化铜质量为_________ g(以含a、b的代数式表示)。
(3)丙称量样品③强热后剩余的固体,质量比原样品减小了cg,若该固体为金属铜,则样品③中氧化铜物质的量(n)的取值范围为_________________________________。
23..(8分)抗击“非典”期间,过氧乙酸是广为使用的消毒剂,它可由H2O2和、冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0涉及下列反应:
 ① MnO4-
+ H2O2
+ H+
═ Mn2+ + O2
+ H2O
① MnO4-
+ H2O2
+ H+
═ Mn2+ + O2
+ H2O
② H2O2 + 2I- + 2 H+ ═ I2 + 2 H2O
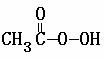
③ + 2I- + 2 H+ ═ CH3COOH + I2 + 2 H2O
I2 + 2S2O32- ═ S4O62- + 2 I-
请回答下列问题:
(1)配平反应①的离子方程式:
 MnO4-
+ H2O2
+ H+
═ Mn2++ O2 + H2O
MnO4-
+ H2O2
+ H+
═ Mn2++ O2 + H2O
(2)用Na2S2O3标准溶液滴定I2是(反应④)选用的指示剂是 。
(3)取b0mL待测液,用硫酸使溶液酸化,再用浓度为a1mol·L-1的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取b0mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟KI反应生成I2(适应②和③)。再用浓度为a2mol·L-1的Na2S2O3标准溶液滴定生成的I2,,耗用Na2S2O3的体积为b2mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、 b1 、b2 、b0的代数表示)
c0 = .
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 (填是或否)。
22.(4分)乙知下列两个热化学方程式;
H2(g)+ O2(g)===H2O(1); △H=-285.kJ/mol
O2(g)===H2O(1); △H=-285.kJ/mol
C3H8(g)+5O2(g)===3CO2(g)+4H2O(1); △H=-2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6264.5kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(1)=H2O(g);△H=+44.0kJ/mol
写出丙烷燃烧生成CO2和气态水的热化学方程式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com