
题目列表(包括答案和解析)
2.利用排列组合解决化学问题
在分析化学组成、结构单元等问题时可以利用排列组合的知识将具体问题抽象化,可以简化解题过程。

A.1 B.3 C.5 D.6
答案:D、C
例5 现有10种α-氨基酸,①能构成多少有三个不同氨基酸单元的三肽?②能构成多少种只有两种不同氨基酸单元的三肽?
解析:根据数学中的排列组合知识,确定此题属于有序性排列。

1.利用二元一次方程组解题
有关混合物计算是高中化学中常见的类型,其解题过程大体可分为两个阶段,第一阶段利用化学知识找出题目中各物质或量的关系,第二阶段利用关系列出方程计算得出结果。值得指出的是化学计算中十字交叉法、差量法均是二元一次方程组独特的运算方法。
例1 元素X和Y在周期表中位于相邻的两个周期,X和Y两原子的核外电子数之和为19,Y原子的原子核内质子数比X多3个,则下列叙述不正确的是 [ ]
A.X和Y都是化学性质很活泼的元素,它们在自然界中只能以化合态存在
B.X和Y形成的化合物的化学式可以是Y2X2
C.元素X形成的化合物种类比元素Y形成的化合物种类多
D.Y的单质能置换出盐酸中的氢,不能置换出稀CuSO4溶液里的Cu2+
解析:设元素X和Y核外电子数分别为x和y,根据题目条件,列二元一次方程组
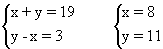
这是将化学关系抽象成数学模型、利用数学工具解决化学问题的解题过程。
答案:A
例2 取一根镁条置于坩埚内点燃,得到氧化镁和氮化镁混合物的总质量为0.470g。冷却后加入足量的水,将反应产物加热蒸干并灼烧,得到的氧化镁质量为0.486g。
(1)写出氮化镁与水反应生成氢氧化镁和氨的化学反应方程式。
(2)计算燃烧所得混合物中氮化镁的质量分数。
Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
设:燃烧后生成氮化镁xmol。氧化镁ymol。
根据镁原子守恒Mg3N2-3Mg
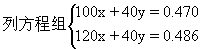
解得x=0.0008,氮化镁的质量分数为:17.0%。
例3 1993年报道的合成烃中,有一种烃A为C1134H1146,其分子中只含有三种结构单元(Ⅰ-Ⅱ):
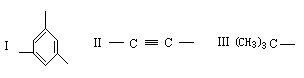
化学式为CnHm的烃,若m<2n+2,则该烃及该烃的烃基就具有一定的不饱和度(也叫缺氢指数),化学式为CnHm的烃的不饱和度计算式为(2n+2-m)/2;如A的三种结构单元中(Ⅰ)的不饱和度为4,(Ⅱ)的不饱和度为2;(Ⅲ)的不饱和度为0。试求:
①A分子中有上述结构单元Ⅰ、Ⅱ、Ⅲ各多少个?
②若另一种烃B的化学式为C1398H1278,则其不饱和度为多少?
分析:本题可用列三元一次方程组的方法解题
①设:(Ⅰ)、(Ⅱ)、(Ⅲ)单元各为x个、y个、z个
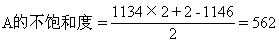
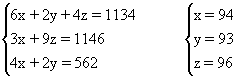
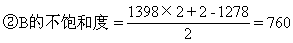
2.在电流强度为IA,通电时间为ts后,精确测得某电极上析出的铜的质量为mg。
试回答:
(1)连接这些仪器的正确顺序为(用图中标注的仪器接线柱的英文字母表示。下同):
E接______,C接______,______接F。
实验装置线路中的电流方向为______→______→______→______→______→______。
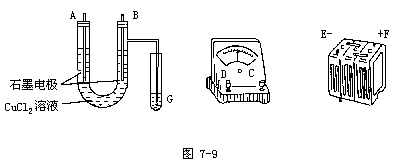
(2)写出 B极发生反应的离子方程式______,G试管中淀粉KI溶液变化的现象为______,反应的离子方程式为______。
(3)为精确测定电极上析出铜的质量,所必须的实验步骤的先后顺序应是______(选填下列操作步骤的编号)。
①称量电解前电极的质量②刮下电解后电极上的铜③用蒸馏水冲洗电解后电极④低温烘干电极后称量⑤高温烘干电极后称量⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19C。试列出阿伏加德罗常数的计算表达式:
NA=______。
解析:该题要求用电解法根据电极上析出物质的质量来验证阿伏加德罗常数数值,是将物理和化学有机融合在一起的试题。它改变了化学实验考核仅仅是玻璃仪器连接的考法,不仅要求学生能正确地把电解装置中电解池和直流电源相连接,而且要求在电解装置中串联一只电流表。此题最后给出了电子的电量,要求根据电解后电极上析出铜的质量。列出阿伏加德罗常数的计算公式。
(1)连接这些仪器的正确顺序为E接D,C接A,B接F。
连接的实物图如图7-10。
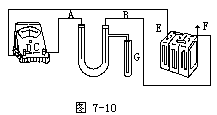
实验装置线路中的电流方向为F→B→A→C→D→E。
(2)写出B极发生反应的离子方程式2Cl--2e→Cl2↑,G试管中淀粉KI溶液变化蓝色,相应的离子方程式Cl2+2I-=2Cl-+I2。
(3)为精确测定电极上析出铜的质量,所必须的实验步骤的先后顺序应是①、③、④、⑥。
本实验的最终目的是正确的称量电极上析出铜的质量,因此,电解前必须正确称量电极的质量,电解完成后,正确地称量电解的增加值,是关键的一步。它首先要用蒸馏水清洗电极上残留的铜离子和氯离子,然后要烘干洁净的电极,但是要注意不能在较高的温度下操作,否则电极上的铜易被氧化,造成称量的误差。为了避免称量中的误差,对电极要再次低温烘干后称量至恒重。
(4)已知电子的电量为1.6×10-19C。在单位时间内电路中通过的总电量为Q=It。铜失电子总数和电路中通过电子总数相等。


例4 由实验得知,用电解法将电解液中的金属离子还原为金属单质时,电极所通过的电量Q正比于金属的物质的量n和金属离子化合价a的乘积,其比例系数F是一个恒量,称为法拉第常数,它与金属的种类无关。
已知:阿伏加德罗常数NA=6.023×1023 mol-1,电子电量e=1.60×10-19C
Cu的原子量:64×10-3kg·mol-1
①如果电解硫酸铜溶液获得1kg的金属铜,通过电解槽的电量是多少?
②用电铰的方法在半径为R的钢球壳表面均匀的镀上很薄的银层,在电镀槽中钢球是阳极还是阴极?另一电极是什么材料?若电流强度为I,银的相对原子质量为A,金属银的密度为ρ,求镀层的厚度 d(其他用本题中的符号表示,法拉第常数为9.64×104C·mol-1)。
1.用直流电电解氯化铜溶液,所用的仪器如图7-9。
1.电学
氧化还原反应是中学化学内容重要组成部分,氧化还原过程中伴有电子转移发生,电子转移或移动恰好是物理学中的电学中的内容,通过电子转移将二者联系起来。原电池(或电解池)为氧化还原反应的重要的应用,形成原电池(或电解池)时负极(或阳极)失电子总数和正极(或阴极)得电子总数相等,电子转移成为它们的桥梁,可以通过此桥梁求解相关的量;在有电场存在下正负电荷分别向高电势和低电势方向移动成为物理学与化学的又一结合点。
例1 两根镍棒分别与电源正、负极相连,并都插入NiSO4溶液中,若电流强度为I,通电时间为ts,结果阳极质量减少mg。已知每个电子的电量为1.6×10-19C,则可推知阿伏加德罗常数为______。
解析:本题金属作为阳极,由单质变成Ni2+失电子总数和导线中电子流动总数相等形成解题的桥梁。

求得:NA=(58.69×I×t)/(1.6×10-19×2m)
例2 100.0g无水氢氧化钾溶于100.0g水。在T温度下电解该溶液,电流强度I=6.00A,电解时间10.00h。电解结束温度重新调至T,分离析出的KOH·2H2O固体后,测得剩余溶液的总质量为164.8g。已知不同的温度下每100g溶液中无水氢氧化钾的质量为:

求温度T,给出计算过程,最后计算结果只要求两位有效数字。
注:法拉第常数F=9.65×104C/mol,相对原子质量:K39.1 O16.0 H1.01
解析:此题为物理学和化学相结合,根据电解规律可知,电解KOH相当于电解水,阴阳两极得失电子总数和电路中转移电子数相等,此为解题的关键。电解反应是水分解为氢和氧。时间10.00h,电流强度6.00A,总共提供电量Q=It=216×103C,相当于2.24mol电子,每电解1mol水需电子2mol,故有1.12mol水,即20.1g水被电解。从剩余溶液的总质量可知有35.2g物质离开溶液,其中有20.1g水被电解,故结晶的KOH·2H2O的质量为15.1g。故:

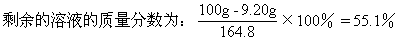
根据溶解度数据,T应在20-30℃之间,故溶解度与温度的线性关系方程式为:
T=20℃+(55.1-52.8)/(65.8-52.8)×10℃=28℃
例3 某学生试图用电解法根据电极上析出物质的量来验证阿伏加德罗常数,其实验方案的要点为:
24.FeS能跟盐酸反应生成 气体和
气体和 .把8.8g
FeS放入200mL2.0mol/L的盐酸中,以制备
.把8.8g
FeS放入200mL2.0mol/L的盐酸中,以制备 .反应完全后,若溶液中
.反应完全后,若溶液中 的浓度为0.01mol/L,假定溶液的体积不变,试计算
的浓度为0.01mol/L,假定溶液的体积不变,试计算
(1)收集到的 的体积;
的体积;
(2)溶液中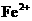 的浓度.
的浓度.
23.已知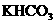 在
在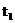 ℃时的溶解度为50g,向该温度下的
℃时的溶解度为50g,向该温度下的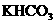 饱和溶液300g中加入148g一定浓度的硝酸,恰好完全反应,求
饱和溶液300g中加入148g一定浓度的硝酸,恰好完全反应,求
(1)反应前该饱和溶液中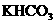 的物质的量是多少?
的物质的量是多少?
(2)完全反应后得 溶液的质量分数是多少?
溶液的质量分数是多少?
22.(11分)阿斯匹林(AsPPrin)是应用最广泛和最成功的合成药物,具有解热、抗炎和镇痛等作用,(已知有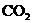 可在苯环上引入羧基)合成过程包括以下操作程序:
可在苯环上引入羧基)合成过程包括以下操作程序:
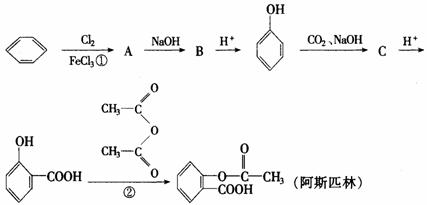
回答下列问题
(1)写出A、B、C的结构简式
A________ B________ C________
(2)写出C与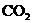 水溶液反应的反应式:________.
水溶液反应的反应式:________.
(3)①的反应类型属于________反应.反应②可看作是________反应,在此反应中为提高产率,用乙酸酐(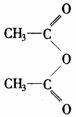 二分子乙酸脱去一分子水的产物)代替乙酸,其原因是________.
二分子乙酸脱去一分子水的产物)代替乙酸,其原因是________.
(4)阿斯匹林药片需保存在干燥处,返潮的药片便不能服用,检验其是否变质最灵敏的试剂________.
21.(5分)四种有机物A、B、C、D分子式均为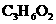 ,把它们分别进行实验并记录现象如下:
,把它们分别进行实验并记录现象如下:
|
|
NaOH溶液 |
银氨溶液 |
新制 |
金属钠 |
|
A |
发生中和反应 |
不反应 |
溶解 |
生成氢气 |
|
B |
不反应 |
有银镜反应 |
有红色沉淀 |
放出氢气 |
|
C |
发生水解反应 |
有银镜反应 |
有红色沉淀 |
不反应 |
|
D |
发生水解反应 |
不反应 |
不反应 |
不反应 |
四种物质的结构简式为
A________________ B________________或________________
C________________ D________________
20.(8分)1000℃时,在密闭容器中加入一定量的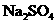 固体使其发生以下反应并达平衡
固体使其发生以下反应并达平衡
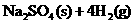
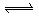
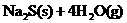 ;DH=+Q(表示反应吸热)
;DH=+Q(表示反应吸热)
在恒温恒容时回答以下问题:
(1)向容器分别加入以下物质,对平衡有无影响,有影响的应写出平衡移动的方向.
①加入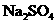 ________ ②加入焦炭________
________ ②加入焦炭________
(2)若初时加入的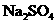 是1.42g,平衡时容器中固体物质的质量是1.10g,
是1.42g,平衡时容器中固体物质的质量是1.10g,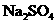 的转化率是____________________
的转化率是____________________
(3)若将容器温度升高20℃,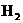 在混合气体中的含量变化是________________趋势.
在混合气体中的含量变化是________________趋势.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com