
题目列表(包括答案和解析)
7、在下列条件下,两种气体分子数一定相等的是:
A、同质量、不同密度的N2和C2H4; B、同温度、同体积的O2和N2;
C、同体积、同密度的CO和C2H4; D、同压强、同体积的N2和O2;
6、向Fe2(SO4)3 、CuCl2的混合溶液中投入足量的铁粉充分反应后,得固体经过滤、干燥、称重,知所得固体的质量与加入的铁粉质量相等,则原混合溶液中[SO42-]与[Cl-]之比是:
A、3:2; B、1:7; C、2:7; D、3:14;
5、用NA表示阿伏加德罗常数,下列叙述正确的是:
A、通常情况下5.6LH2含0.5NA个原子;
B、2.4g金属镁变为镁离子时失去的电子数为0.1NA;
C、0.5L PH=2的H2SO4溶液中含0.005NA个H+;
D、124g白磷中共价键数目为4NA个;
4、某白色固体可能是由①NH4Cl 、②AlCl3、③NaCl、④AgN03、⑤KOH中的一种或几种
组成。将此固体投入水中,得澄清溶液,该溶液可使酚酞呈红色,向该溶液中加稀硝酸
至过量,有白色沉淀产生。以下对原固体的判断中不正确的是:
A、肯定存在①; B、至少存在①④⑤;
C、无法确定是否有③; D、至少存在②和⑤;
3、向稀硫酸中加入铜粉不发生反应,若再加入下列某种盐,则铜粉可以逐渐溶解。符合此
条件的盐是 ( )
A、NaN03; B、KCl; C、ZnS04; D、FeSO4 ;
2、法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也
有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是 ( )
A、该粒子不显电性; B、该粒子质量数为4;
C、在周期表中与氢元素占同一位置; D、该粒子质量比氢原子大 ;
1、某无水盐在30℃时的溶解度为50g,20℃时的溶解度为20g。若将100g质量分数
为30%的该盐溶液从30℃降到20℃,析出无水晶体的质量是:
A、16 g; B、12 g; C、10 g ; D、1 g;
5.利用不等式解题
根据题设条件求最大值或最小值,从而确定取值范围来解决问题,解题过程中往往可根据某种物质组成的有或无来确定最大值或最小值,有时也可以依据方程式来确定。
例9 今有10.8g碱金属M及其氧化物M2O的混合物与水反应,生成碱16g,则M为
A.Li B.Na
C.K D.Rb
解析:假设10.8g全部是碱金属M,根据2M+ 2H2O=2MOH+H2解得M的相对原子质量小于35。
假设10.8g全部是碱金属氧化物M2O。
根据M2O+H2O=2MOH解得M的相对原子质量大于11,所以碱金属相对原子质量在11-35之间。
答案:B
例10 A、B两种化合物的溶解度曲线如图7-1。现要用结晶法从A、B的混合物中提取A。(不考虑A、B共存时,对各自溶解度的影响)
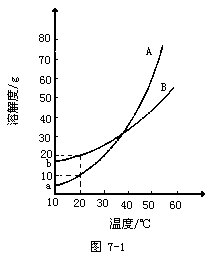
(1)取50g混合物,溶于100g热水中,然后冷却到 20℃,若要使A析出而B不析出,则要求混合物中B的质量最高不超过多少?
(2)取Wg混合物,溶于100g热水,再冷却至10℃。若仍要A析出而B不析出,请写出在以下两种情况下,混合物中A的质量分数(A%)应满足的条件?(以W、a、b表示)
当w<a+b时,A%______;
当W>a+b时,A%______。
分析:当W>a+b时,只有WB≤b,B才不至于析出,-WB≥-b,两边均加W导出W-WB≥W-b,因为W-WB=WA,
所以WA≥W-b,两边同除以W得出答案。
答案:(1)WB≤20g(2)A%>a/W A%≥(W-b)/W
例11 在一个容积固定的反应容器中,有一可左右滑动的密封隔板,两侧分别进行如下图所示的可逆反应,各物质的起始加入量如下:A、B C均为4.0mol,D为6.5mol,F为2.0mol。设E为xmol, x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中间位置。填写下列空白:
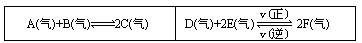
(1)若x=4.5,则右侧反应在起始时向______方向进行。欲使起始反应维持向该方向进行,则x的取值范围为______。
(2)若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?______,其理由是______。
分析:根据题意列出6.5-a+x-2a+2+2a=12
x-2a>a且a>0
x=3.5+a
保持平衡向正向移动的前提下解得x>3.5。
答案:(1)正;3.5-7.0(2)不等;温度不同,平衡状态不同。
例12 若A是相对分子质量为128的烃,则其分子式只可能是______。若A是易升华的片状晶体,则其结构简式为:______。
解析:设烃的分子式为CxHy,相对分子质量为M,则M=12x+y;y=M-12x。因为y/2(任何烃分子中的氢原子数大于2,只有乙炔分子中氢原子数等于2),因为y≤2x+2(任何烃分子中的氢原子均不能大于其碳原子数的两倍加2),得不等式2≤M-12x≤2x+2。
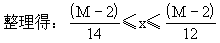
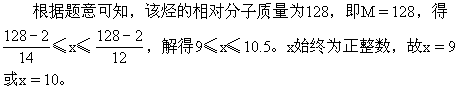
即A的分子式为C9H2O或C10H8。
由题中所给的已知条件看,解题所得的两种物质,能升华的片状晶体只能是萘,则其分子式只能是C10H8,其结构简式为 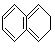 。
。
例13 已知氟化氢气体中存在着下列平衡2(HF)3 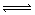 3(HF)2,(HF)2
3(HF)2,(HF)2 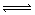 2HF。
2HF。
若平衡时气体的平均摩尔质量是42g/mol,试通过论证(HF)3的体积分数必大于10%。
解析:解题的前提是相同的条件下,混合气体中各组分的体积分数等于其物质的量分数。
解法1:设(HF)3占体积分数为x,(HF)2占的体积分数为y,HF占1-x-y。
60x+40y+20(1-x-y)=42
2x+y=1.1,因为1-x-y>0,x+y<1。故x=1.1-(x-y)>0.1,即(HF)3的体积分数必大于10%。
解法2:设(HF)3占x,(HF)占y,(HF)2占1-x-y。
60x+40y+40(1-x-y)=42,x-y-0.1,因为y>0,所以x>0.1,即(HF)3的体积分数必大于10%。
解法3:用反证法:①设(HF)3的体积分数等于10%,HF的体积分数为x,(HF)2的体积分数为0.9-x,则:60×10%+40(0.9-x)+20x=42,x=0,而x不可能为零,故(HF)3的体积分数不等于10%。
②设(HF)3的体积分数小于10%。
则有40(0.9-x)+20x>36,x<0不合理,故(HF)3的体积分数不可能小于10%,综合①、②结论,(HF)3的体积分数必大于10%。
4.利用等比数列解决化学问题
例8 一定的条件下,将等体积NO和O2的混合气体置于试管中,并将试管倒立于水槽中,充分反应后剩余气体的体积为原总体积的 [ ]
A.1/4 B.3/4
C.1/8 D.3/8
解析:设 NO和O2的物质的量均为n。则反应2NO+O2=2NO2和3NO2+H2O=2HNO3+NO可知,nmolNO与n/2molO2反应生成n molNO2,溶于水后得n/3molNO;n/3molNO与n/6molO2反应生成n/3 molNO2,溶于水后得n/9molNO;……继续反应下去,总耗O2量为下列等比数列各项之和:n/2,n/6,n/18…n/(2×3k-1),依等比数列的求和公式,得总耗氧量S=(n/2)/(1-1/3)=3n/4,剩余O2为n-3n/4=n/4mol,则剩余O2的体积为原总体积的1/8。故正确答案为C。
说明:此题也可以用其他的方法来求解。
3.利用等差数列、极值解决化学问题
例6 在沥青中含有稠环的芳烃,其中偶数个苯的可视为同系物,如:
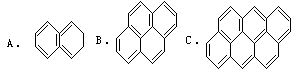
①求第25个分子的分子式;
②求含碳量的极限。
解析方法1:①经观察分析 A、B、C分子式分别为C10H8、C16H10、H22H12碳原子数和氢原子数递增呈等差数列,由通项公式an=a1+(n-1)d,求出该一系列有机物的通式;C原子数:公差为6,首项是10,an=a1+(n-1)d=10+(n-1)×6=6n+4。
H原子数:公差是2,首项是8an=a1+(n-1)d=8+(n-1)×2=2n+6。
所以通式为C6n+4H2n+6,第25个分子的分子式为C154H56。
②求含C量的极限
方法2:求含C量的极限
因为n趋于无穷大
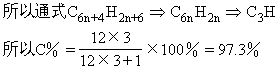
例7 有一系列α-氨基酸按如下特点排列:
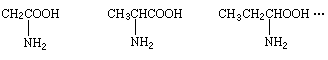
该系列化合物中碳元素的质量分数的最大值为 [ ]
A.32% B.46.6%
C.85.7% D.无法确定

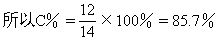
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com