
题目列表(包括答案和解析)
1.从石油中提取的矿物燃烧后,产生的气体对环境会造成污染。为减少汽车尾气对大气污
染,1998年我国成功地制造出以新燃料作能源的“绿色汽车”,这种新燃料是 ( )
A.90号汽油 B.甲醇 C.97号汽油 D.0号汽油
23.(11分)对一定量的KClO3加热使其部分分解,然后向反应后的混合物中加入足量浓
H2SO4并加热发生如下反应:
|
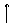 KClO3 + 5KCl + 3H2SO4
3Cl2 + 3K2SO4
+ 3H2O
KClO3 + 5KCl + 3H2SO4
3Cl2 + 3K2SO4
+ 3H2O
假设原KClO3为m mol,第一步反应KClO3分解为α,两步反应生成的O2与Cl2总物质的量为n mol.
(1)计算当氯元素全部转化为Cl2时α值及n与m的函数关系式。
(2)讨论在α不同值时,n与α、m的函数关系式及n的最大值。
22.(9分)白色粉末A由Na2S、Na2SO3、Na2SO4和NaCl等物质中三种混合而成,取一定A样品,投入100ml 2.2mol·L-1盐酸中,充分反应后过滤,最终得100ml含H+的物质的量浓度为1 mol·L-1的滤液。若将此滤液蒸干,只得到8.19g纯净物B.
(1)B的化学式
(2)A中是否有NaCl (填“有”或“没有”)
(3)若反应后还生成0.896L(标准状况)气体,且气体不会使品红褪色。则原取的A样
品中含有Na2S物质的量。
21.(10分)把H2S通入碘水中,过滤出生成的硫,可得一定浓度的氢碘酸,氢碘酸可被空气中的O2氧化为I2。I2在水溶液中易与红磷反应生成PI3,并水解生成HI和H3PO3(亚磷酸)
(1)写出氢碘酸氧化变质的离子方程式: ;
(2) (填“能”或“不能”)用浓硫酸与固体NaI共热制HI,原因是:
.
(3)在配制的氢碘酸溶液中,可加入少量的红磷。当该溶液置于空气中时,只要溶液的
体积不变,则所配制HI溶液的物质的量浓度不会变化。其原因是(用化学方程式
表示):
19.(6分)右图所示装置是化学实验中常见的仪器,它除用于洗气,还有其它用途。
(1)医院里给病人输氧时,往往在氧气钢瓶与病人呼
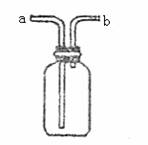 吸面具之间安装有水的该装置,用于观察气泡产
吸面具之间安装有水的该装置,用于观察气泡产
生的情况,以便调节供氧速率,此时氧气应从
(填标号,下同)管口导入。
(2)实验室用MnO2与浓HCl反应制Cl2的实验中,
将生成的Cl2通入NaOH溶液之前,先将Cl2从该
装置 管口导进,从 管口导出。此
时该装置所起的作用是防止NaOH溶液倒吸入反应器。
(3)当用此装置收集NO时,应采取的主要操作步骤是
①
②
 20.(10分)氧化二氯是具有刺激性气味的棕黄色气体,沸点38℃,熔点-116℃.制备时生成的Cl2O要冷却成固态以便操作和贮存。它与一般有机物接触会发生爆炸。遇水较易溶解(1∶100)生成次氯酸溶液。制备少量固态Cl2O可用干燥的Cl2与HgO反应,生成Cl2O和HgO·HgCl2.装置如下图:
20.(10分)氧化二氯是具有刺激性气味的棕黄色气体,沸点38℃,熔点-116℃.制备时生成的Cl2O要冷却成固态以便操作和贮存。它与一般有机物接触会发生爆炸。遇水较易溶解(1∶100)生成次氯酸溶液。制备少量固态Cl2O可用干燥的Cl2与HgO反应,生成Cl2O和HgO·HgCl2.装置如下图:
试回答:
(1)(A)中盛有的固体深色试剂a是 ,分液漏斗中试剂b是 。
(2)(B)中盛液体C是 ;其作用是 ;(C)中液体d是 ,
其作用是 。
(3)(D)中发生化学反应的化学方程式是 .
(4)(E)中的保温瓶中盛有致冷剂是 (在干冰,冰盐水,液态空气、液氨中选择)。在(E)的内管所得的氧化二氯中可能存在的主要杂质是 。
(5)装置(A)、(B)、(C)、间的连接方式与(D)、(E)间的连接方式有明显的区别,这区别是 。用这些不同的连接方式的主要理由是 。
18.在反应aBrF3+bH2O = cHBrO3+dHBr+eHF+fO2中(a、b、c、d、e、f是各物质的化学计量数),若0.3molH2O被氧化,则被水还原的BrF3的物质的量是 ( )
A.0.15mol B.0.2 mol C.0.3 mol D.0.4 mol
第Ⅱ卷(非选择题,共46分)
17.有Mg、Al、Fe、Cu四种金属,若两两混合,取26g混合物与足量稀H2SO4反应,产生11.2LH2(标准状况)。此混合物的可能组合的方式最多有 ( )
A.2种 B.3种 C.4种 D.5种
16.多硫化钠Na2Sx(x≥2)在结构上与Na2O2、FeS2、CaC2等有相似之处。Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1∶16,则x值是 ( )
A.5 B.4 C.3 D.2
15.已知某溶液的①体积 ②密度 ③溶质和溶剂的质量比 ④溶质的摩尔质量,要根据溶质的溶解度计算其饱和溶液的物质的量浓度时,上述条件中必不可少的是 ( )
A.①②③④ B.①②③ C.②④ D.①④
14.由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能够说明这个结论的是 ( )
A.已经制得了IBr、Icl等卤素互化物
B.已经制得I2O5等碘的氧化物
C.已经制得了I(NO3)3、I(ClO4)3·2H2O等含I3+离子化合物
D.碘(I2)易溶于KI等碘化物溶液,形成I3-离子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com