
题目列表(包括答案和解析)
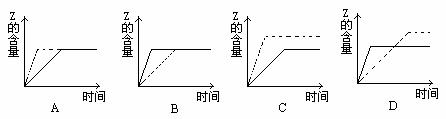
2、已知:X(g)+Y(g)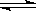 3Z(g),A与B在有催化剂条件下发生反应建立平衡如图实线所示,在无催化剂条件下发生反应建立平衡如图虚线所示,则相应的图示正确的是( B )
3Z(g),A与B在有催化剂条件下发生反应建立平衡如图实线所示,在无催化剂条件下发生反应建立平衡如图虚线所示,则相应的图示正确的是( B )
1、一种比黄金贵百倍的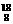 O2气体,近年在兰州近代物理研究所研制成功,有关
O2气体,近年在兰州近代物理研究所研制成功,有关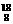 O2气体的下列说法中正确的是( D )
O2气体的下列说法中正确的是( D )
A.它是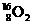 的一种同素异形体 B.它是
的一种同素异形体 B.它是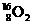 的同分异构体
的同分异构体
C.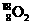 与
与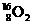 互为同位素 D.氧气中含有
互为同位素 D.氧气中含有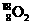 分子,仍属纯净物
分子,仍属纯净物
10.平均值法(利用平均值原理解题)
是一种将数学平均原理应用于化学计算的解题方法。它所依据的数学原理是:两个数X1和X2(X1 > X2)的算术平均值X一定介于二者之间,即 X1 > X > X2。所以,只要求出平均值X,就可以判断出取值范围
例10 30g某两种金属的混合物投入足量盐酸中,产生11.2L的氢气(标准状况)。组成该混合物的可能的金属组是
A.Fe Zn B.Sn Zn C.Mg Al D.Mg Cu
解析:因为要在标准状况下产生11.2L氢气,各需要纯金属:镁12g、铝9 g、铁28 g、锌32.5 g、锡59.4 g,而铜不反应。由此可见,组成混合物的两种金属,单独置换出11.2L氢气,一种质量要大于30g,另一种质量要小于30g,故答案为A、D。
在高中化学的学习中,还有很多这样的例子。如果我们能够在学习中合理地利用数学工具,加强学科之间的相互渗透,就能够拓宽我们的视野,活化我们的思维,就能够真正做到将知识转化为能力。
9.奇偶数法(利用奇偶数性质解题)
例9 X、Y是短周期元素,二者能组成化合物X2Y3,已知X的原子序数为n,则Y的原子序数不可能的是
A.n+11 B.n – 6 C.n+3 D.n+4
分析:根据化学式X2Y3可知X价态为+3或+6、Y价态为– 2或 – 4,但若X为+6、Y为 – 4不能成立,所以根据X、Y是短周期元素可以判断出X为奇数族数的元素,Y为偶数族数的元素,族数差必为奇数。
答案:B、D
8.差量法(利用合比定理解题)
差量法的数学依据:
对于A + B = B + D
a b
有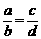
c d
依分比定理: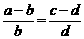
又依更比定理: 或
或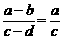 (
(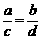 )
)
例8 把碳酸钠和碳酸氢钠的混合物146g加热到质量不再继续减少为止,剩下的残渣的质量是137g,计算原混合物中碳酸钠的质量。
分析:加热后质量的减少是由于碳酸氢钠受热分解放出二氧化碳和水蒸气,并转化为碳酸钠所引起的。
解:设混合物中含有碳酸钠质量为x
2NaHCO3=Na2CO3 + CO2↑+ H2O △m
168g 106g 168g-106g
x 146g-137g
解得:x = 24.4g
因此,原混合物中含有碳酸钠质量为146-24.4 = 121.6g
7.守恒法(利用等量代换原理解题)
化学反应本质是原子的重组,故由质量守恒定律可推出元素在反应前后都保持:(1)原子的质量守怛;(2)元素原子或离子的物质的量守恒,即元素守恒或称物料守恒。
例7 38.4 g铜与适量的浓硝酸反应,铜全部作用后,共收集到气体22.4L(标准状况)。反应消耗的HNO3的物质的量可能是( )。
(A)1.0mol (B)1.6mol (C)2.2mol (D)2.4mol
解析:铜与浓HNO3反应成成NO2,反应一段时间后,HNO3浓度降低,剩余的铜与稀HNO3反应生成NO。反应后的产物是Cu(NO3)2、NO2、NO、H2O。运用元素物质的量守恒法,反应前后氮元素的物质的量不变,则
n(HNO3) = 2n [Cu(NO3)2] + n(NO2) + n(NO)
=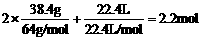
即参加反应的硝酸物质的量为2.2mol,故答案为(C)。
6. 图象法(利用函数图象法解题)
图象法(利用函数图象法解题)
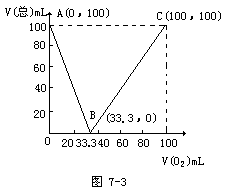
例6 在标准状况下,将100mLH2S和O2的混合气体点燃,反应后恢复到原状况,发现反应所得气体的体积V(总)随混合气体中O2所占的体积V(O2)的变化而不同,其关系如图7-3(气体的体积均在同温、同压下测定)。用含V(总)和V(O2)的函数式表示V(总)和V(O2)的关系。
解析:此题一看就很容易联想到H2S与O2的反应,然后根据H2S或O2过量的不同情况来列关系式。但如果从数学的角度来解此题会更简便。由化学方程式可知AB,BC段符合线性关系,所以可以利用数学上求分段函数的知识得出AB,BC两段的方程。
AB段的斜率为-3,BC段的斜率为3/2,由截距式和两点式可得AB,BC段的方程:
AB段:V(总)=100 – 3V(O2),0<V(O2)≤33.3。
BC段:V(总)=3V(O2)/2 – 50,33.3<V(O2)≤100;即为V(总)和 V(O2)的关系。
5.不等式法(利用不等式解题)
例5 若A是相对分子质量为128的烃,则其分子式只可能是______。若A是易升华的片状晶体,则其结构简式为:______。
解析:设烃的分子式为CxHy,相对分子质量为M,则M=12x+y;y=M-12x。因为y/2(任何烃分子中的氢原子数大于2,只有乙炔分子中氢原子数等于2),因为y≤2x+2(任何烃分子中的氢原子均不能大于其碳原子数的两倍加2),得不等式2≤M-12x≤2x+2。
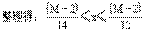

即A的分子式为C9H20或C10H8。
由题中所给的已知条件看,解题所得的两种物质,能升华的片状晶体只能是萘,则其分子式只能是C10H8,其结构简式为  。
。
4.数列法(利用数列、极值等解题)
例4 在沥青中含有稠环的芳烃,其中偶数个苯环结构的可视为同系物,如:
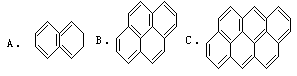
①求第25个分子的分子式;
②求含碳量的极限。
解析方法1:①经观察分析 A、B、C分子式分别为C10H8、C16H10、C22H12,碳原子数和氢原子数递增呈等差数列,由通项公式an = a1+(n – 1)d,求出该一系列有机物的通式;C原子数:公差为6,首项是10,an = a1+(n – 1)d = 10 + (n – 1)×6 = 6n + 4。
H原子数:公差是2,首项是8an = a1+(n – 1)d = 8 + (n – 1)×2 = 2n + 6。
所以通式为C6n+4H2n+6,第25个分子的分子式为C154H56。
②求含C量的极限
方法2:求含C量的极限
因为n趋于无穷大
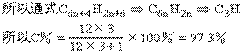
3.极值法(利用极值思维解题)
例3 某碱金属及其氧化物(R2O)组成的混合物4g,与水充分反应后蒸干得固体5 g,则该碱金属可能是
A.锂 B.钠 C.钾 D.铷
解析:解此题可用极限思维。
极限1:当4 g物质全是碱金属R时
2R + 2H2O =2ROH + H2↑ △m
(2Ar)g 34 g
4 g 5 g-4 g
Ar = 68
极限2:当4 g物质全是碱金属氧化物R2O时
R2O + H2O =2ROH △m
(2Ar+16)g 18 g
4 g 5 g-4 g
Ar = 28
事实上,R相对原子质量介于28-68之间,符合题意的只有钾元素。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com