
题目列表(包括答案和解析)
7.在某溶液中酚酞呈粉红色。下列离子在该溶液中不能大量共存的是
A.K+ B.Na+ C.Ba2+ D.Al3+
6.23He可以作为核聚变材料。下列关于23He的叙述正确的是
A.23He和13H互为同位素
B.23He原子核内中子数为2
C.23He原子核外电子数为2
D.23He代表原子核内有2个质子和3个中子的氮原子
31.黄铜矿(主要成分CuFeS2)是提取铜的主要原料
(1)取12.5 g黄铜矿样品,经测定含3.60 g硫(杂质不含硫),矿样中CuFeS2含量为
。
(2)已知2CuFeS2+4O2 Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)
产物Cu2S在1200℃高温下继续反应:
2Cu2S+3O2→2Cu2O+2SO2
2Cu2O+ Cu2S→6Cu+SO2
假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量。
②6 mol CuFeS2和14.25 mol O2反应,理论上可得到多少摩尔铜。
③6 mol CuFeS2和15.75 mol O2反应,理论上可得到多少摩尔铜。
30.氢氧化钡是一种使用广泛的化学试剂。某课外活动小组通过下列实验测定某试样中Ba(OH)2·nH2O 的含量。
(1)称取3.50g试样溶于蒸馏水配成100 mL溶液,从中取出10.0 mL溶液于锥形瓶中,加2滴指示剂,用0.100 mol/L HCl标准溶液滴定至终点,共消耗标准液20.0 mL(杂质不与酸反应)。求试样中氢氧化钡的物质的量。
(2)另取5.25 g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09 g。求Ba(OH)2·nH2O中的n值。
(3)试样中Ba(OH)2·nH2O的质量分数为 。
29.从石油裂解中得到的1,3-丁二烯可进行以下多步反应,得到重要的合成橡胶和杀菌剂富马酸二甲酯。
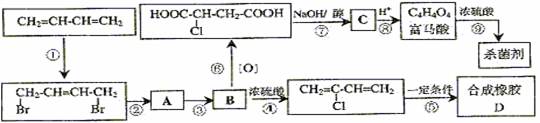
(1)写出D的结构简式 ;
(2)写出B的结构简式 ;
(3)写出第②步反应的化学方程式 ;
(4)写出富马酸的一种相邻同系物的结构简式 ;
(5)写出第⑨步反应的化学方程式 ;
(6)以上反应属于消去反应的是 (填入编号)。
28.人们对本的认识有一个不断深化的过程。
(1)1834年德国科学家米希里希,通过蒸馏安息香酸( )和石灰的混合物得到液体,命名为苯。写出苯甲酸钠与碱石灰共热生成苯的化学方程式
。
)和石灰的混合物得到液体,命名为苯。写出苯甲酸钠与碱石灰共热生成苯的化学方程式
。
(2)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出C6H6的一种叁键且无支链的结构简式 ,苯不能使溴水褪色,性质类似烷烃,任写一个苯发生取代反应的化学方程式 .
(3)烷烃中脱去2 mol氢原子形成 1 mol双键要吸热。但1,3-环己二烯(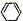 )脱去 2 mol氢原子变成苯却放热,可推断苯比1,3-环己二烯 (填稳定或不稳定)。
)脱去 2 mol氢原子变成苯却放热,可推断苯比1,3-环己二烯 (填稳定或不稳定)。
 (4)1866年凯库勒(右图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列 事实。(填入编号)
(4)1866年凯库勒(右图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列 事实。(填入编号)
a.苯不能使溴水褪色 b.苯能与H2发生加成反应
c.溴苯没有同分异构体 d.邻二溴苯只有一种
(5)现代化学认为苯分子碳碳之间的键是 。
27.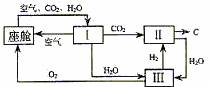 航天飞行器座舱内空气更新过程如图所示:
航天飞行器座舱内空气更新过程如图所示:
(1)Ⅱ是CO2和H2的反应装置,该反应的化学方程式
。
(2)从装置Ⅰ、Ⅱ、Ⅲ可看出,O2的来源是CO2和H2O,宇航员每天消耗28 molO2,呼出23 mol CO2,则宇航员每天呼出的气体中含H2O mol。
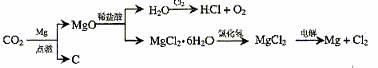 (3)以下是另一种将CO2转化为O2的实验设想:
(3)以下是另一种将CO2转化为O2的实验设想:
其中,由MgCl2·6H2O制取无水MgCl2有部分装置(铁架台、酒精灯己略)如下:
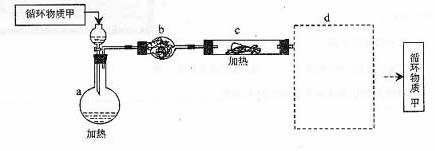
①上图中,装置a由 、 、双孔塞和导管组成;
②循环物质甲的名称是 ;
③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是 ;
④装置b中填充的物质可能是 (填入编号)
e .硅胶 f .碱石灰 g .无水氯化钙 h . 浓硫酸
⑤设计d装置要注意防止倒吸,请在方框中画出d装置的简图,并要求与装置c的出口处相连(铁架台不必画出)。
26.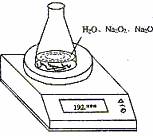 某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560 g、锥形瓶和水的质量为 190.720 g),利用如图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560 g、锥形瓶和水的质量为 190.720 g),利用如图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
(1)写出N2O2 和H2O反应的化学方程式 。
(2)计算过氧化钠质量分数时,必需的数据是
。不必作第6次读数的原因是 。
(3)测定上述样品(1.560 g)中Na2O2质量分数的另一种方案,其操作流程如下:
样品↓稀盐酸
操作Ⅰ → 溶液转移 → 操作Ⅱ  称量
称量
①操作Ⅱ的名称是 。
②需直接测定的物理量是 。
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要 、 。(固定、夹持仪器除外)
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果 (填偏大、偏小或不变)。
25.右表是元素周期表的一部分。
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填“强”或“弱”)。
(2)某元素原子的核外电子p电子数比s电子数少1,则该元素的元素符号是 ,其单质的电子式为 。
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
1 |
① |
|
|||||
|
2 |
② |
③ |
④ |
|
⑤ |
⑥ |
|
|
3 |
|
⑦ |
⑧ |
|
|
⑨ |
⑩ |
(3)俗称为“矾”的一类化合物通常含有共同的元素是 。
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式:
。又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)。
|
|
读数次数 |
质量(g) |
|
锥形 瓶+ 水+ 试样 |
第1次 |
192.214 |
|
第2次 |
192.164 |
|
|
第3次 |
192.028 |
|
|
第4次 |
192.010 |
|
|
第5次 |
192.010 |
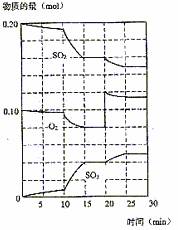
24.在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g) 2SO3(g)+Q(Q>0)
2SO3(g)+Q(Q>0)
 (1)写出该反应的化学平衡常数表达式
(1)写出该反应的化学平衡常数表达式
K=
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速率 (以上均填“增大”、 “减小”或 “不变”)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
(4)据图判断,反应进行至20 min时,曲线发生变化的原因是
(用文字表达),10 min 到15 min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容积体积 c.降低温度 d.增加SO3的物质的量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com