
题目列表(包括答案和解析)
7.下列物质中硫元素既能被氧化,又能被还原的是( )
A.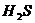 B.S
C.
B.S
C. D.
D.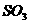
6.向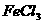 和
和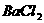 的酸性混合物溶液中通入
的酸性混合物溶液中通入 气体,有白色沉淀生成,此沉淀是( )
气体,有白色沉淀生成,此沉淀是( )
A. B.
B.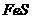 C.
C.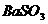 D.S
D.S
5.下列事实能用同一原理解释的是 ( )
A. ,
,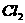 均能使品红溶液褪色
均能使品红溶液褪色
B.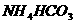 晶体、固体
晶体、固体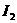 受热均能变成气体
受热均能变成气体
C.S与Fe、Cu反应均生成低价硫化物
D.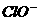 与
与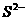 、
、 均不能生存
均不能生存
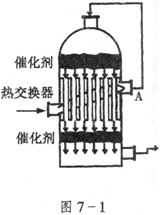
4.如图7-1所示,在硫酸工业生产中,为了有利于 的转化,且能够充分利用热能,采用了中间有交换器的接触室。按此密闭体系中气体的流向,则在A处流出的气体为 ( )
的转化,且能够充分利用热能,采用了中间有交换器的接触室。按此密闭体系中气体的流向,则在A处流出的气体为 ( )
A. B.
B.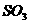 ,
,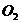 C.
C. ,
,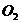 D.
D. ,
,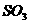
3.下列容器中,最不宜于制造储存浓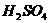 的容器是( )
的容器是( )
A.铁 B.铝 C.铜 D.陶瓷
2.市场上销售的某消毒液,其商品标识上有如下叙述:①本产品为无色液体,呈碱性;②使用时,加水稀释;③可对餐具、衣服进行消毒,也可漂白浅色衣物。据此,可推断该产品的有效成份可能是 ( )
A.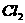 B.
B. C.
C. D.
D.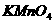
1.某气体在近地面空气中浓度稍大时是一种污染物,而在高空却对人类有保护作用,该气体是( )
A.NO
B.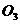 C.CO
D.
C.CO
D.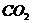
24.(12分)为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的 ,再向吸收液中加入浓硫酸,以制取高浓度的
,再向吸收液中加入浓硫酸,以制取高浓度的 及
及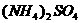 和
和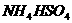 固体。为测定上述
固体。为测定上述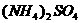 和
和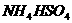 固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出
固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出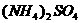 和
和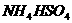 的分解温度均高于200℃],测得有关实验数据如下(标准状况):
的分解温度均高于200℃],测得有关实验数据如下(标准状况):
|
实验序号 |
样品的质量/g |
NaOH 溶液的体积/Ml |
氨气的体积/L |
|
Ⅰ |
7.4 |
40.00 |
1.68 |
|
Ⅱ |
14.8 |
40.00 |
3.36 |
|
Ⅲ |
22.2 |
40.00 |
1.12 |
|
Ⅳ |
37.0 |
40.00 |
0.00 |
(1)实验过程中有关反应的离子方程式为_______________________;
(2)由Ⅰ组数据直接推测:标准状况下3.7g样品进行同样实验时,生成氨气的体积为__________________L;
(3)试计算该混合物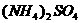 和
和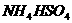 的物质的量之比;
的物质的量之比;
(4)欲计算该NaOH溶液的物质的量浓度应选择第____________组数据,由此求得NaOH溶液的物质的量浓度为______________。
23.(10分)将某温度下的 溶液200g蒸发掉10g水,恢复到原温度,或向其中加入
溶液200g蒸发掉10g水,恢复到原温度,或向其中加入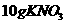 固体均可使溶液达到饱和。试计算:
固体均可使溶液达到饱和。试计算:
(1)该温度下 的溶解度;
的溶解度;
(2)原未饱和溶液的质量分数。
22.(11分)现有等物质的量的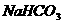 和
和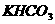 的混合物ag与100mL盐酸反应。题中涉及的气体体积均以标准状况计,填空时可以用带字母的公式表示。
的混合物ag与100mL盐酸反应。题中涉及的气体体积均以标准状况计,填空时可以用带字母的公式表示。
(1)该混合物中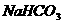 与
与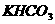 的质量比为____________。
的质量比为____________。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸的浓度为______________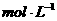 。
。
(3)如盐酸过量,生成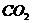 体积为__________L。
体积为__________L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成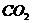 的体积,还需要知道______________。
的体积,还需要知道______________。
(5)若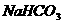 和
和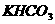 不是以等物质的量混合,则ag固体混合物与足量的盐酸完全反应时生成
不是以等物质的量混合,则ag固体混合物与足量的盐酸完全反应时生成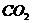 的体积(V)范围是____________。
的体积(V)范围是____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com