
题目列表(包括答案和解析)
11.实验室将NaClO3和Na2SO3按物质的量之比为2∶1倒入烧杯中,用水浴加热,同时滴入硫酸溶液,产生棕黄色的气体X。反应后,测得NaClO3和Na2SO3正好完全反应,则X为
A.Cl2 B.Cl2O C.ClO2 D.Cl2O3
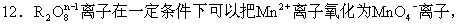
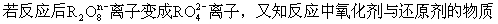

A.+3 B.+5 C.+6 D.+7
10.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的物质的量浓度之比为1∶3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为
A.21∶5 B.4∶1 C.3∶1 D.11∶3
9.氯化碘(ICl)的性质类似卤素,有很强的化学活动性。ICl跟Zn、H2O的反应如下:
①2ICl+2Zn=ZnCl2+ZnI2 ②ICl+H2O=HCl+HIO
下列叙述中正确的是
A.在反应①中,ZnI2既是氧化产物又是还原产物 B.在反应①中,ZnCl2既是氧化产物又是还原产物 C.在反应②中,ICl既是氧化剂又是还原剂 D.在反应②中,Icl既不是氧化剂,又不是还原剂
8.在反应aBrF3+bH2O=cHBrO3+dHBr+eHF+fO2中(a,b,c,d,e,f是各物质的化学计量数),若0.3molH2O被氧化,则被水还原的BrF3的物质的量是
A.0.15mol B.0.2mol C.0.3mol D.0.4mol
7.已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2。则下列反应不能发生的是
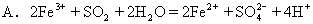 B.I2+SO2+2H2O=H2SO4+2HI
C.H2O2+H2SO4=SO2↑+O2↑+2H2O
D.2Fe2++I2=2Fe3++2I-
B.I2+SO2+2H2O=H2SO4+2HI
C.H2O2+H2SO4=SO2↑+O2↑+2H2O
D.2Fe2++I2=2Fe3++2I-
5.从矿物学资料查得:当胆矾溶液渗入地下,遇黄铁矿(FeS2)时,可生成辉铜矿(Cu2S),同时还生成FeSO4和H2SO4。下列有关的叙述中正确的是
A.在反应中,FeS2既是氧化剂又是还原剂 B.在反应中,CuSO4是氧化剂,FeS2是还原剂 C.反应中Cu2+与FeS2的物质的量之比是14∶5 D.反应中每生成1molCu2S共得2mol电子
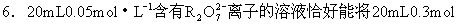 ·L-1的Fe2+溶液完全氧化,则元素R在还原产物中的化合价为
·L-1的Fe2+溶液完全氧化,则元素R在还原产物中的化合价为
A.+2价 B.+3价 C.+4价 D.+5价
4.G、Q、X、Y、Z均为氯的含氧化合物。我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平):
①G→Q+NaCl
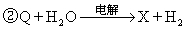
③Y+NaOH→G+Q+H2O
④Z+NaOH→Q+X+H2O
这五种化合物中,氯的化合价由低到高的顺序为
A.Q、G、Z、Y、X B. G、Y、Q、Z、X C. G、Y、Z、Q、X D. Z、X、G、Y、Q
3.根据下列反应判断有关物质还原性由强到弱的顺序是
H2SO3+I2+H2O=2HI+H2SO4
2FeCl3+2HI=2FeCl2+2HCl+I2
3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3
A.H2SO3>I->Fe2+>NO B.I->Fe2+>H2SO3>NO C.Fe2+>I->H2SO3>NO D.NO>Fe2+>H2SO3>I-
2.下列叙述中正确的是
A.元素的单质可由氧化含该元素的化合物来制得 B.失电子越多的还原剂,其还原性就越强 C.阳离子只能得电子被还原,作氧化剂 D.含有最高价元素的化合物一定具有强氧化性
1.一定条件下,硝酸铵受热分解的未配平化学方程式为:NH4NO3===HNO3+N2+H2O,在反应中被氧化与被还原的氮原子数之比为
A.1∶1 B. 5∶4 C. 5∶3 D.3∶5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com