
题目列表(包括答案和解析)
2.为了除去蛋白质溶液中混入的少量氯化钠,可以采用的方法是( )
A.过滤 B.电泳
C.渗析
D.加入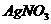 溶液过滤
溶液过滤
1.下列气体不能用浓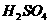 干燥的是(
)
干燥的是(
)
A.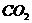 B.
B.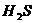 C.
C.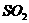 D.HC1
D.HC1
26.(10分)在密闭容器中使3.62g NaOH、Na2S、Na2SO3的混合物溶于50mL某浓度的稀硫酸中,不放出任何气体,再加入100mL 0.10mol/L的Ba(OH)2溶液,正好中和过量的硫酸,将反应所得沉淀洗净、烘干、称重,其质量为3.29g。求原混合物中各物质的质量。
25.(9分)已知Cl2在70℃的NaOH水溶液中,能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO与NaClO3的物质的量比为4∶1。现有49.7gCl2,将其通入到足量70℃的NaOH水溶液中,反应完全后得500mL溶液。
(1)写出Cl2在70℃的NaOH水溶液中符合上述条件的总反应方程式。
(2)计算完全反应后各生成物的物质的量浓度(除H2O外)。
24.(1分)在标准状况下进行甲、乙、丙三组实验:各取30mL同浓度的盐酸溶液,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量(g) |
0.255 |
0.385 |
0.459 |
|
生成气体体积(mL) |
280 |
336 |
336 |
试回答:
(1)甲组实验中,盐酸,乙组实验中盐酸(均填“过量”、“适量”或“不足量”)。
(2)要推导出盐酸的物质的量浓度,所提供的数据中作计算依据的是______________,计算出盐酸的物质的量浓度为________mol/L。
(3)要求出合金中镁、铝的物质的量之比,可作计算依据的数据是________________,镁、铝的物质的量之比为________。
(4)在丙组实验之后,向容器中加入一定体积1mol/L的苛性钠溶液,可恰好使铝元素 全部以偏铝酸根形式存在,并使镁离子刚好沉淀完全,则溶液中偏铝酸钠的物质的量为_______mol,氯化钠的物质的量为________mol,所加苛性钠 溶液的体积为________mL。
23.(8分)有关物质有下图所示的转化关系。其中,A的浓溶液与单质B在加热时才发生反应①,A的稀溶液与足量B发生反应②,D的稀溶液与苯酚溶液混合后呈紫色。
据此填空:
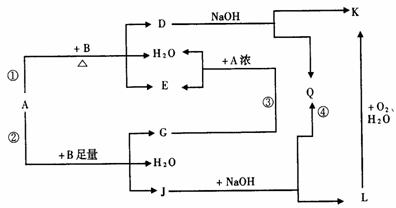
(1)写出下列物质的化学式
A________,D________,E________ 。
(2)反应④的现象是________________;
(3)写出反应②的离子方程式:________________;
(4)A浓溶液与单质B加热时能否产生G?为什么(结合图给信息回答)?
22.(12分)从物质A的水溶液出发,有下图所示的一系列变化(参加反应或反应生成 的水均略去未表示):
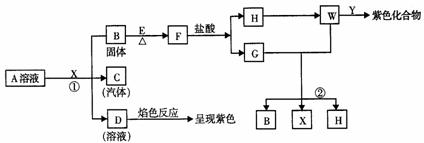
(1)写出下列物质的化学式(有机物写结构简式):
A________,F________,X________ ,Y________。
(2)写出反应①的离子方程式:________________。
(3)写出反应②的化学方程式:________________。
21.(8分)下图表示一些常见无机物之间的转化关系:
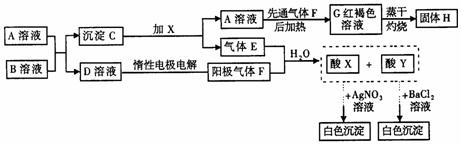
(1)请写出下列物质的化学式:
X________,Y________,H________ 。
(2)E与F等体积混合溶于水生成X+Y的离子方程式为________,A与B反应的离子方程式为________,电解D溶液的离子方程式为______________________。
20.(10分)A、B、C、D均为短周期元素,B、A可形成两种液态化合物,其原子个数比 分别为:1:1和2:1,且分子中电子总数分别为地和10;B与D能形成一种极易溶于水的碱性 气体X,B与C能形成极易溶于水的酸性气体Y。X分子与B2A分子中的电子数相同、Y分子中 的电子数为18,A、B、D形成离子化合物,其化学式为B4A3D2,其水溶液呈弱酸性;请回答:
(1)元素符号A________、B________、C________、D________。
(2)写出化学方程式:C2和X(过量)反应________________。
(3)B4A3D2的化学式________,其水溶液呈酸性的离子方程式 ________________。
(4)液态X能电离(可根据B2A电离推知),其阴离子电子式___________________。
19.(9分)已知X和Y均为短周期元素,单质X在空气中点燃,能发出耀眼的白光,在一定条件下,单质X和单质Y反应,生成化合物Z,Z与水作用可生成气体G和白色沉淀P(如下框图所示),已知气体G与氢气之密度比约为8.5。
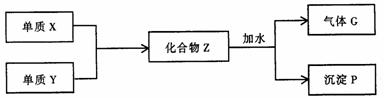
(1)组成单质X和Y的元素分别属第________族和第________族。
(2)化合物Z的化学式为________________。
(3)每生成1mol的气体C,同时应得到________mol的沉淀P。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com