
题目列表(包括答案和解析)
2.一包质量为 23.24 克的粉末,它是由NaCl、CuSO4、Na2O2、(NH4)2SO4、Na2SO4、KNO3等
7 种物质中的某几种混和而成。
(a) 将粉末全部投入足量蒸馏水中,得无色溶液和气体,加热使反应完全,收集到的气体
干燥后体积共为3.36升(标准状况);
(b) 将所得溶液分成两等份。一份中滴入酚酞试液,呈现红色,用浓度为4摩/升的盐酸中
和消耗12.5毫升;
(c) 向另一份中加稀硝酸酸化,无气体产生,加入过量Ba(NO3)2溶液,得到白色沉淀,
经过滤干燥,质量为12.815克,滤液中加入AgNO3溶液无现象;
(d) 所得的3.36升气体通过浓H2SO4,体积明显减少;再通过碱石灰,体积不改变。
请根据以上实验现象和数据,分析并确定该粉末由哪些物质组成?
质量各是多少克?
1.用高岭土(主要成分是Al2O3·2SiO2·2H2O,并含有少量CaO、Fe2O3)研制新型净水剂(铝
的化合物)。
其实验步骤如下:
将土样和纯碱混匀,加热熔融,冷却后用水浸泡熔块,过滤,弃去残渣。滤液用盐酸酸化,经过滤,分别得到沉淀和溶液,溶液即为净水剂。
(1) 写出熔融时主要成分与纯碱的反应方程式?
[答]:
(2) 最后的沉淀物是( H2SiO3 ), 生成该沉淀的离子方程式是:
SiO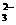 + 2H
+ 2H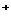 = H2SiO3 ↓
= H2SiO3 ↓
请判断:( )
(3) 实验室中常用的有瓷坩埚、氧化铝坩埚和铁坩锅,本实验在熔融土样时,
应选用( )坩埚。
(A) 瓷坩埚 (B) 氧化铝坩埚
(C) 铁坩锅 (D) 以上都不对。
3.某化学兴趣小组在空气中加热硫粉与铁粉的混和物制取FeS, 现有浓H2SO4、浓HNO3、稀HCl、稀HNO3、FeCl3溶液、NH4SCN 溶液及氨水。简述用最简便可靠的实验方法检验残余固体中是否含有少许Fe2O3.
[答]:
2.根据2KMnO4+10FeSO4+8H2SO4 = 2MnSO4+5Fe2(SO4)3+ K2SO4+8H2O的反应,在实验室里可
以选用与酸碱中和滴定相同的仪器和操作方法,测定绿矾中FeSO4 的百分含量。实验步
骤顺序如下:
① 称取绿矾样品W克,配成100 毫升溶液。
② 取25.0 毫升待测液,置于锥形瓶中,再加入适量H2SO4溶液供滴定使用。
③ 将m 摩/升的标准KMnO4溶液装入滴定管,调节液面该度至a毫升处。
④ 用标准KMnO4 溶液滴定待测液。
⑤ 该实验是用反应物自身颜色变化指示反应终点,到滴定终点时,滴定管内液面的高度为
6毫升。
⑥ 重复滴定操作2-3次。
⑦ 计算。
请根据以上实验步骤填写有关内容。
(1) 实验步骤(1)中,应从下列仪器中选取的是( )
A. 托盘天平(含砝码、镊子) B. 50毫升酸式滴定管 C. 100毫升量筒
D. 100毫升容量瓶 E. 烧杯 F. 胶头滴管 G. 锥形瓶 H. 玻棒 I. V形纸槽 J. 药匙
(A) A、D、E、F、G (B) B、D、F、H、J
(C) A、D、E、F、H、J (D) A、D、F、G、H
(2) 不能用( 碱)式滴定管盛放KMnO4 溶液。
请判断:( )
(3) 锥形瓶用蒸馏水洗净的标志是(瓶内壁不挂水珠,不成股流下).
请判断:( )
若锥形瓶未干燥,对实验结果( )
(填1---“偏高”、2---“偏低”、3---“无影响”)
(4) 滴定时,两眼应注视锥形瓶的溶液颜色的变化;达到滴定终点的标志是
(KMnO4 溶液滴入后不再褪色).
请判断:( )
1.现用MnO2与浓盐酸反应制氯气,再用铜粉和氯气制以少量CuCl2的实验,其实验流程示意
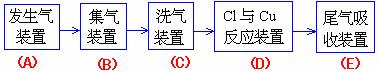 如图:(图中“→”表示气体流向。)
如图:(图中“→”表示气体流向。)
(1) B 与C 所需用的仪器是( )
(A)玻璃管 (B) 洗气瓶
(C)干燥管 (D) 酒精灯
B 中应选用的试剂是(水或饱和食盐水).
请判断:( )
C 中选用的试剂的作用是(吸收L2中的水蒸气)。
请判断:( )
(2) 在Cl2和铜粉反应的实验中,根据什么现象判断已有CuCl2生成?
[答]:
(3)E 中应选用的试剂只能从下列物质中选择: ( )
(A) NaBr 溶液 (B) 纯水
(C) KMnO4溶液 (D) Na2SO3溶液
23. 检验某病人血液中的含钙量,现取10毫升血液样品,稀释后用草酸铵[(NH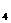 )
)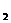 C
C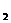 O
O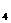 ]
]
溶液处理成草酸钙沉淀。过滤出此沉淀将其溶于稀硫酸中,然后用0.5摩/升的高锰酸
钾溶液滴定,恰好用去高锰酸钾溶液1.60毫升。题中有关反应的离子方程式为:
Ca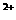 + C2O
+ C2O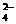 = CaC2O4↓
= CaC2O4↓
CaC2O4
+ 2H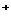 = Ca
= Ca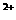 + H2C2O4
+ H2C2O4
5H2C2O4
+ 2MnO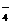 + 6H
+ 6H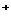 = 2Mn
= 2Mn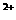 + 10CO2↑+8H2O
+ 10CO2↑+8H2O
则该病人血液中含钙量为( )
(A) 2.4 克/升 (B) 8 克/升
(C) 6 克/升 (D) 12 克/升.
22. 将m克CaCO3与n克KHCO3分别加入100毫升0.5摩/升盐酸中,若反应后两种溶液的质
量相等,则m与n的关系是( )
(A) m=n,且均≤2.5 (B) m=n,且均>2.5
(C) m=n,且均≥5 (D) m<n<2.5
21. 将乙烯、一氧化碳、氮气3种气体分别盛放在3个容器中,并保持3个容器内气体的温
度和密度均相等,这3种气体对容器壁所施压强的大小关系是( )
(A) C2H4>CO>N2 (B) C2H4= CO = N2
(C) CO>C2H4>N2 (D) N2>C2H4>CO
20. 下列离子方程式书写错误的是( )
(A) 硫化亚铁和稀硫酸反应: FeS+2H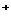 =Fe
=Fe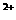 +H2S↑
+H2S↑
(B) 铁片溶于硫酸铁溶液中: 2Fe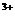 +Fe=3Fe
+Fe=3Fe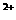
(C) 氢氧化钡溶液跟稀硫酸反应:Ba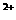 +SO
+SO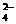 +H
+H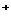 +OH
+OH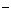 =BaSO4↓+H2O
=BaSO4↓+H2O
(D) 向硝酸铜溶液中通入硫化氢气体:Cu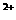 +H2S=CuS↓+2H
+H2S=CuS↓+2H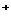
19. 13克Zn投入500毫升1摩/升的HNO3溶液中,二者均可反应完全,
下列说法错误的是( )
(A) HNO3中每个N原子都得到4个电子
(B) HNO3的还原产物可能为N2O
(C) HNO3的还原产物可能为HN4NO3
(D) 反应过程中HNO3共得到0.4摩电子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com